În mod natural cele două substanțe cu punct de fierbere soluție - apă (p.f. = 100 ° C la 760mm.rt.st) și etanol (punct de fierbere = 78,3 ° C la 760mm.rt.st) trebuie să fie situate între punctele de fierbere ale substanțelor individuale. Dependența temperaturii vaporilor de apă-alcool saturate sau a punctului de fierbere (vaporizarea) acestui amestec binar asupra concentrației de alcool în vaporii de Y este prezentată în Fig.
Trebuie notat că pe acest grafic există un punct A cu o concentrație de 96,4%, temperatura în care este chiar mai mică decât punctul de fierbere al etanolului 100%.
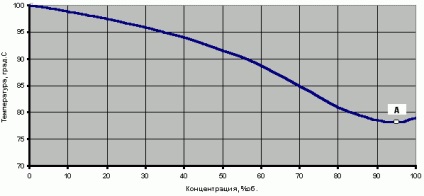
Fig.1 Temperatura vaporilor de apă-alcool saturate sau punctul de fierbere al unui amestec apă-alcool (la o presiune de 760 mm Hg)
Starea de echilibru a fazelor (lichid și vapori) este coexistența lor, în care nu apar schimbări aparente calitative sau cantitative ale acestor faze. Echilibrul de fază este considerat realizat numai dacă sunt îndeplinite simultan două condiții: temperaturile de fază sunt egale, iar presiunile parțiale ale fiecărei componente în faza de vapori și lichid sunt egale. A doua condiție înseamnă că procesul de trecere a frontierei de fază a fiecărui component din faza lichidă către faza de vapori și spate este finalizat. Ie compozițiile fazelor lichide și de vapori sunt stabilizate și concentrațiile componentelor într-o singură fază sunt aceleași în fiecare punct al volumului său.
Pentru un amestec binar de apă-alcool, această declarație teoretică înseamnă un lucru foarte simplu. Dacă un balon convențional (schematic desenată în graficul din Figura 2) pentru a turna o cantitate mică de amestec apă-alcool, cu concentrația Xzh și se încălzește până la punctul de fierbere al amestecului, perechea în concentrația de alcool format va Yn. Apoi, în cazul în care aproape flask rapid și se agită energic (vapori de agitare și fază lichidă), temperatura din interiorul conului este egalizată, iar vaporii și lichidul ajunge la echilibru - cu concentrații în lor Y și X, respectiv alcool.
Dacă astfel de experimente se efectuează pentru diferite concentrații de soluții apă-alcool, atunci este posibil să se obțină o anumită relație de echilibru de fază - curba de echilibru de fază. Diagrama curbei de echilibru de fază pentru amestecul binar de alcool pur + apă pură este prezentată în Fig.
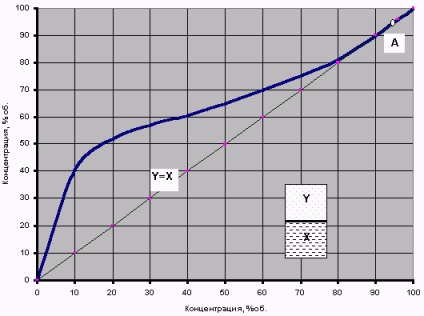
Fig.2 Curba de echilibru a fazelor amestecului apă-alcool binar
(la o presiune de 760 mm Hg)
Semnificația teoretică și practică a curbei de echilibru de fază în ceea ce privește procesul de distilare a alcoolului este foarte mare, dar vom reveni la acest lucru mai târziu în secțiunea „rectificare“, iar acum arată cum să folosească această curbă.
De exemplu, în distilarea convențională a borhotului cu o concentrație de alcool de X = 10% este generat abur la o concentrație = 42% spirtaY în ea și după condensarea, obținem „infuzare“ (distilat condensat) Aceeași „cetate“. Astfel, dacă lunca nu este echipată cu alte "clopote și fluiere", atunci este teoretic pur și simplu imposibil de a obține un ton mai puternic în acest mod teoretic. În același mod, puteți "anticipa" cu aceeași curbă și rezultatul re-distilării "pervach" - de la 40% distilat, cea de-a doua distilare poate obține 60% "moonshine".
Având în vedere acest grafic, merită acordat atenție diagonalei Y = X. Tocmai pentru că aproape toată curba de echilibru se află deasupra acestei diagonale, este posibil să se evapore amestecul apă-alcool pentru a obține o concentrație de alcool în vapori mai mare decât concentrația sa în lichidul inițial. Excepția este numai punctul A - intersecția curbei de echilibru cu diagonala, unde X = Y = 96,4%. Acesta este un punct special al azeotropului.
Azeotropul sau fierberea inseparabilă se numește un amestec în care vaporii în echilibru cu lichidul au aceeași compoziție ca și amestecul lichid (X = Y). La distilarea amestecurilor azeotrope se formează un condensat cu aceeași compoziție ca și amestecul inițial. Se exclude separarea acestor amestecuri prin distilare și rectificare.
Amestecul de apă-alcool în punctul special al azeotropului se numește "alcool etilic-rectificat (SR)". Este la acest punct are ca scop procesul de rectificare, care este o concentrație de alcool de limitare în acest proces, și în acel moment amestecul de apă-alcool, are un punct de fierbere minim (B.P. = 78,15 ° C la 760mm.rt.st. Cm. Fig. 1).