Știința materiei se bazează pe cunoașterea modernă a atomilor - cele mai mici particule de elemente și molecule - cele mai mici particule de compuși chimici. Atomii au o dimensiune de ordinul a 10
8 cm (un angstrom). Moleculele mari care conțin mii de atomi au o dimensiune de aproximativ 10
6 cm Natura mișcării moleculelor și a atomilor, interacțiunea lor determină în care starea agregată este substanța - solidă, lichidă sau gazoasă.
Moleculele pot efectua mișcări de translație, rotație și vibrație. Dacă substanța este în stare gazoasă sau lichidă, atunci toate cele trei tipuri de mișcări sunt posibile. Dacă substanța se solidifică, forma predominantă de mișcare a moleculelor și a atomilor devine oscilații.
Când studiază starea materiei, ei caută să găsească relația dintre presiune. la care este localizată substanța, densitatea și temperatura acesteia. Dacă denotăm presiunea p. densitate # 961;, iar inversa ei valoare - volumul specific al substanței V și temperatura T, starea substanței va fi caracterizată de p, V și T sau, ca in termodinamica, -sootnosheniem. Cel mai simplu, acest raport apare la starea de materie, în care moleculele efectuează mișcare de translație între coliziuni unele cu altele, iar forțele intermoleculare nu apar în mod vizibil. O astfel de stare de materie este caracteristică gazelor suficient de rarefiate. O substanță în această stare este numită gaz ideal. Pentru gazele ideale, conform ecuației Clapeyron-Mendeleev
unde este presiunea, Pa; - volumul gazului, m 3 - masa gazului, kg; - constantă gaz, J / (kg • K); - temperatura absolută, K.
Constanta gazului este numeric egală cu munca de extindere a 1 kg de gaz ideal într-un proces izobaric, cu o creștere a temperaturii gazului cu 1 K.
Cu o compresie ridicată a gazului, parametrii săi nu mai vor fi descriși de ecuația de stare a unui gaz ideal. Van der Waals a introdus următoarele corecții în ecuația stării unui gaz ideal (2.27): b. luând în considerare volumul moleculelor în sine și cantitatea a / v 2. luând în considerare interacțiunea dintre molecule. Ca rezultat, ecuația de stare a "gazului real" (ecuația lui Van der Waals) a fost obținută în următoarea formă:
Dificultatea cu ecuația (2.28), în scopuri practice este că în realitate există gazoneftepromyslovom de obicei un amestec de gaze, pentru care ecuația van der Waals aplicabile cu dificultate.
Un bun acord cu datele experimentale pentru gaze a căror densitate nu depășește două treimi din densitatea gazelor în condiții critice se obține prin ecuația Beattie-Bridgman
unde a, b, c, A0 și B0 sunt constante pentru aceste componente ale gazului natural, care sunt calculate pe baza datelor experimentale.
Coeficient de superconductivitate. Cu un număr mare de componente, calculele de formulele de mai sus devin consumatoare de timp. Prin urmare, pentru a calcula starea gazelor reale de obicei sunt generalizate sub forma Clapeyron drept gaz în care o corecție (factor supercompressibility), ținând seama de devierea gazului real prin compresie și expansiune legile gazelor ideale.
unde z este coeficientul de supercompresibilitate; - masa gazului în kg; p este presiunea în Pa; V este volumul gazului în m 3; R este constanta de gaz în J / (kg * deg); T este temperatura absolută în K.
Natura schimbării coeficientului de supercompresibilitate z, care arată raportul dintre volumul unui gaz real și volumul unui gaz ideal în aceleași condiții, cu o schimbare a temperaturii și presiunii, poate fi stabilită luând în considerare diferența dintre gazele reale și cele ideale. În cel de-al doilea, moleculele ocupă un volum mic (în comparație cu volumul gazului) și nu experimentează forțele de atracție unele cu altele. Moleculele gazelor reale au anumite dimensiuni, masă și interacționează unul cu celălalt. Prin urmare, gazul real se apropie de ideal la presiuni scăzute, atunci când numărul de molecule pe unitate de volum este mic. În consecință, la presiuni scăzute, valoarea coeficientului de compresibilitate ar trebui să fie aproape de unitate. Pe măsură ce crește presiunea, moleculele de gaze converg și forțele atractive dintre molecule încep să ajute forțele externe care comprimă gazul. Din acest motiv, gazele reale trebuie comprimate mai mult decât în condiții ideale, gazele ideale sunt comprimate. În consecință, cu creșterea presiunii, factorul de compresibilitate z trebuie să scadă mai întâi. Atunci când gazul de hidrocarburi este comprimat într-o asemenea măsură, încât este aproape în proprietati fluide, distantele intermoleculare sunt reduse, astfel încât acestea încep să se manifeste forțele vzaimoottalkivayuschie dintre moleculele preveni reducerea suplimentară a volumului de gaz. În aceste condiții, gazul de hidrocarbură trebuie să fie comprimat mai puțin decât la presiuni scăzute, adică valorile lui z cresc din nou odată cu creșterea presiunii.
Prin abordarea presiunii și a temperaturii la valorile lor critice, proprietățile fazelor de gaz și lichid devin identice, interfața dintre ele dispare și densitățile lor sunt egale.
Temperatura critică (Tcr) este temperatura maximă la care gazul și lichidul pot coexista încă în echilibru (Tabelul 2.4).
Presiunea critică este presiunea de vapori a substanței la temperatura critică (Tabelul 2.3) și volumul substanței la Tcr și pcr date. raportată la 1 mol sau la o unitate de masă a materiei, se numește volumul critic specific.
Elasticitatea vaporilor de hidrocarburi saturate, această presiune, la care gazul începe să condenseze și să intre în starea lichidă, crește odată cu creșterea temperaturii, cu atât densitatea hidrocarburilor este mai mică.
Tabelul 2.4 Presiuni critice și temperaturi ale componentelor gazelor petroliere
unde p și T sunt presiunea și temperatura gazului; pKpi și Tcri sunt presiunea critică și temperatura absolută a componentei i; = și - temperatura absolută și presiunea absolută critică (pseudocritică); yi este concentrația molară a componentei i în gaz.
Astfel, ppr și Tpr exprimă presiunea și temperatura absolută în fracții ale valorilor critice corespunzătoare.
Diferite gaze având aceeași temperatură și presiune sunt în "stările corespunzătoare".
Conform principiului stărilor corespunzătoare, proprietățile termodinamice ale substanțelor (inclusiv coeficienții de compresibilitate ai diferitelor gaze) având
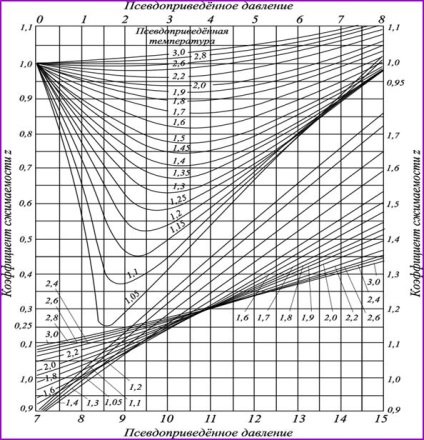
Fig. 2.10. Coeficienții de supercompresibilitate a gazelor de hidrocarburi,
în funcție de parametrii
temperaturile și presiunile date sunt aproximativ aceleași, deoarece în acest caz diferitele gaze sunt ca și cum ar fi în aceeași apropiere relativă cu starea lichidă. Prin urmare, graficele coeficientului de supercompresibilitate z în coordonatele reduse pentru hidrocarburi din aceeași serie omologă coincid cu acuratețea suficientă pentru practică. Pe această bază, graficul (Figura 2.10) poate fi utilizat pentru a calcula volumul specific și alți parametri ai oricărui gaz (inclusiv amestecurile de gaze), dacă sunt cunoscuți parametrii critici (Tabelul 2.4).
Graficele (Figura 2.10) sunt valabile pentru un gaz care nu conține cantități semnificative de componente non-hidrocarbonate. Majoritatea componentelor non-hidrocarbonate sunt de obicei azot. Prin urmare, coeficientul de supercompresibilitate a gazului poate fi calculat prin regula aditivității din formula
unde fracția molară a azotului; - coeficientul de supercompresibilitate a azotului (figura 2.11); - coeficientul de compresibilitate al părții hidrocarbonate a gazului.
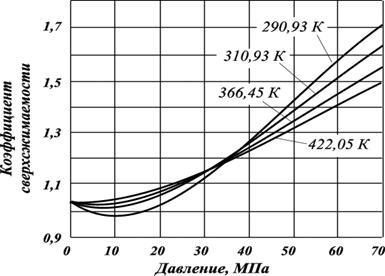
Fig. 2.11. Dependența supercompresibilității azotului la presiune și temperatură
Folosind factorul de supercompresibilitate z, este ușor de determinat volumul de gaz V în condiții diferite. În conformitate cu ecuația (2.30), volumul gazului în orice condiții (temperatura T și presiunea p) va fi egal cu
Factorul volumetric de gaz este utilizat atunci când se recalculează volumul ocupat de gaz în condiții normale pentru condițiile de rezervor și viceversa, de exemplu, la calculul rezervelor.