După cum se vede din ecuațiile de mai sus, în reactorul termic trebuie să cunoască în mod necesar calcularea entalpiei entalpia reacției a componentelor de tranziție de fază și capacitatea componentelor de căldură.
Dacă nu există o valoare tabelară, atunci poate fi determinată entalpia reacției.
Pentru a diviza prin entalpie standard de formare sau de combustie a componentelor în
cu legea lui Hess. Pentru reacție
aA + bB = rR + sS + # 8710; Hr,
Entalpia standard a reacției, calculată din entalpia formării, este
În consecință, entalpia de ardere
Valorile entalpiilor standard ale formării și arderii pot fi găsite în cărțile de referință ale cantităților fizice și chimice. Valoarea entalpiei reacției la temperatura de reacție este dată de ecuație
unde CPi este capacitatea de căldură molară a componentei i-a; T0 este temperatura "standard"; T este temperatura de proiectare.
Entalpia componentelor poate fi calculată utilizând entalpia tranzițiilor de fază
și dependențele de temperatură ale încălzirilor specifice ale fazelor. Dacă este dată nivelul de referință Tc, formula generală va avea apoi forma
Indicele "pl" se referă la temperatura și entalpia topirii, "kip" se referă la temperatura și entalpia de fierbere; "Т", "г" și "г" - în consecință, la un corp solid, un lichid și un gaz. Dependențele de temperatură ale încălzirilor specifice pentru multe substanțe pot fi găsite în cărțile de referință ale cantităților fizico-chimice, unde sunt exprimate prin formulele:
Dacă în intervalul de temperatură dat nu există coeficienți în ecuațiile indicate, atunci putem lua valoarea medie a capacității de căldură obținută din tabele sau calculată din relațiile empirice.
Dependențele empirice ale calculului caloricității depind de starea de fază a substanței. Astfel, capacitatea de căldură molară a metalelor și a altor substanțe cristaline poate fi estimată aproximativ prin regulile Dulong și Petit, care presupun că fiecare atom al compusului contribuie la molecula o fracțiune din căldura specifică, de aproximativ 26 J / (mol # 8729; K). Prin urmare, calculul căldurii specifice a compusului poate fi efectuat prin formula
unde n este numărul de atomi din moleculă; M este greutatea moleculară a compusului, kg / mol.
Capacitatea de căldură a multor solide este o cantitate aditivă și este aproximativ egală cu suma încălzirilor atomice (regula lui Kopp):
,
unde ni este numărul de atomi dintr-o anumită specie; Сi - capacitatea atomică de căldură, selectată din tabel. 9.7.
Tabelul 9.7. Componente atomice ale capacității termice a solidelor
Aici CV și CP sunt capacitățile de căldură pentru volum constant și presiune constantă, respectiv, și R este constanta gazului universal; R = 8,314 J / (mol # 8729; K).
Valoarea aproximativă a căldurii specifice în J / (kg # 8729; K) poate fi obținută din următoarele formule:
unde n este numărul de atomi dintr-o moleculă de gaz sau de vapori; M este greutatea sa moleculară, kg / mol.
Dependența capacității de căldură a gazelor și a amestecurilor de gaze de vapori la presiune și temperatură este determinată în general de formula
unde CP este capacitatea de căldură la presiunea atmosferică, J / (mol # 8729; K);
π - reduce presiunea gazului în exces, π = Р / Ркр; P este presiunea în exces a gazului, Pa; Pcr este presiunea critică a gazului, Pa; # 964; - Temperatura redusă a gazului,
# 964; = T / Tcr; T este temperatura gazului, K; Tcr este temperatura critică a gazului.
Căldura specifică a amestecurilor de gaze și gaze de vapori poate fi determinată aproximativ prin exprimare
unde x este fracția molară sau volumică a componentei din amestec.
Exemplul 9.7. Determinați capacitatea de căldură a azotului la o temperatură de 50 ° C și absolută
presiune de 20 MPa.
Soluție: Conform datelor din literatură pentru azot, temperatura critică este de 125,9 K, presiunea critică este de 3,285 MPa, greutatea moleculară este de 0,028 kg / mol. Să determinăm capacitatea de încălzire izobarică la temperatură obișnuită și la presiunea atmosferică
CP = 1 = 3,5 # 8729; 8,314 = 29,1 J / (mol K).
# 964; = T / Tcr = (273 + 50) / 125,9 = 2,566
Presiune redusă
CP = 29,1 + (2,531 # 8729; 8,314 # 8729; 5,783) / 2,566 = 36,6
Sau prin căldură specifică
Căldura specifică a marii majorități a lichidelor este cuprinsă în intervalul 1600 - 2400 J / (mol # 8729 K), pentru majoritatea hidrocarburilor, acest parametru este aproximativ egal cu 2100 J / (mol # 8729; K).
O estimare aproximativă a capacității de căldură molară a lichidelor poate fi făcută folosind regula Kopp, aplicabilă la o temperatură de 20 ° C:
unde ni este numărul de atomi dintr-o anumită specie; Сi - capacitatea atomică de căldură, selectată din tabel. 9.9.
Capacitatea molară de căldură a lichidelor la 20 ° C poate fi calculată prin metoda Johnson-Huang:
unde ai este componenta atomică sau de grup (a se vedea Tabelul 9.10).
Tabelul 9.9. Componente atomice ale capacității termice a lichidelor
Exemplul 9.8 Se calculează capacitatea de căldură a benzenului (C6H6) prin metoda Johnson-Huang la 20 ° C.
Soluție: Benzenul poate fi reprezentat ca fiind compus din șase grupări = CH-, apoi Cp = 6 # 8729; 22,6 = 135,6 J / (mol # 8729; K).
Valoarea experimentală a tabelului este de 136,2 J / (mol # 8729; K).
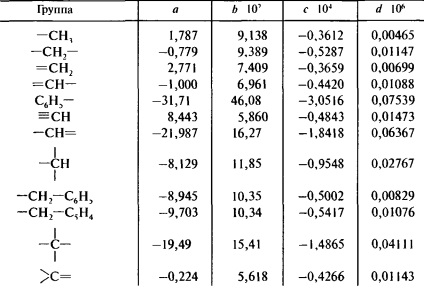
A doua formulă Johnson-Huang face posibilă obținerea dependenței de temperatură a capacității termice
CP = a + bT + cT 2 + dT 3
Coeficienții a, b, c și d sunt prezentați în Tabelul. 9.11.
O caracteristică importantă în calculul termic al reactoarelor poate fi entalpia evaporării. În cazul în care este imposibil să se găsească valoarea tabelară, acesta poate fi calculat. Metoda cea mai simplă, dar nu foarte exactă este regula Truton:
unde Lip.k este entalpia evaporării la punctul de fierbere, J / mol; Tc este punctul de fierbere, K.
Mai precis este metoda Giacocolone:
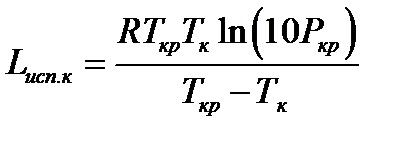
unde Tcr și Pcr sunt temperatura critică (K) și presiunea (MPa).
Tabelul 9.11. Calculul capacității termice prin metoda Johnson-Huang
Entalpia topirii poate fi determinată prin formula
unde Ln este entalpia de topire, J / mol; Tm este punctul de topire, K.
Pentru compușii organici, raportul dintre entalpiile de evaporare și topire are forma