Legile chimice de bază [40]
Legea conservării materiei. Cu toate transformările chimice ale substanțelor între ele, cantitatea lor totală de greutate rămâne neschimbată. Substanțele schimbă doar proprietățile lor chimice și fizice. Materia nu este creată sau distrusă.
Legea conservării energiei. Orice motiv care poate produce un loc de muncă se numește energie. Energia nu dispare și nu apare în sine. În toate cazurile de manifestare a acestui tip de energie, acesta este format dintr-o cantitate echivalentă (echivalentă) de alt tip. În cazul reacțiilor exoterme, energia chimică a substanțelor interacționante este transformată complet sau parțial în energie termică, reacțiile endotermice consumate de energia termică din exterior.
Legea constanței compoziției. La anumiți compuși chimici, raportul de greutate al pieselor este constant.
Legea relațiilor multiple. Dacă două corpuri formează mai mulți compuși între ei, atunci, luând greutatea unui corp ca o constantă, constatăm că greutățile celuilalt corp vor fi în multipli simple unul de celălalt.
Legea lui Avogadro. În volume egale de gaze, în aceleași condiții fizice, se găsește același număr de molecule.
Legea Avogadro - Gerard. Moleculele de substanțe chimice în stare gazoasă sau vapori ocupă volume egale în aceleași condiții fizice.
Legea valenței elementelor. Valence (valoarea, atomicitatea) este abilitatea atomului unui element de a reține sau înlocui unul sau mai mulți atomi de hidrogen, a căror valență (numărul de unități de afinitate) este luată ca una.
Când elementele sunt unite, afinitatea uneia dintre ele este saturată cu unitatea de afinitate a celuilalt element. Astfel, oxigenul, fiind bivalent, se combină cu doi atomi de hidrogen.
Greutatea echivalentă (echivalentă) a elementului este apoi cantitatea sa de greutate, care înlocuiește o unitate de greutate a hidrogenului. Pentru elementele monovalente, echivalentul este egal cu greutatea lor atomică, pentru cele bivalente la jumătate. În general, echivalentul este coeficientul împărțirii greutății atomice cu valența.
Am văzut că elementele chimice sunt împărțite în metale și metaloide. Nu există o distincție clară în acest caz. Astfel, arsenic și antimoniu în formă pură au proprietățile metalelor, în compuși - metaloizi. Iodul și bromul, fiind metaloide caracteristice în formă pură, sunt capabili, în unele compuși, să prezinte proprietățile metalelor; crom și mangan în unele compuși, sub formă pură, - metale puternic pronunțate, în altele - metaloide.
De asemenea, este de remarcat faptul că elementele sunt împărțite în grupuri prin similitudinea proprietăților lor.
Mendeleev, pe baza presupunerii că proprietățile elementelor depind de greutatea lor atomică, clasifică toate substanțele simple cunoscute în vremea lui, plasându-le sub forma unei mese speciale. Într-un mod modern, corectat și augmentat, este afișat pe pagina următoare. Aceasta arată că proprietățile elementelor se află într-o dependență periodică de greutățile lor atomice. Deoarece cantitatea de greutate atomică crește cantitativ, calitatea elementelor se schimbă.
„Rânduri în care are schimbare loc secvențial în proprietățile elementelor, Mendeleev numite perioade în două perioade -. Prin litiu metalic alcalin galloida fluor și gaz argon inert - este de 8 elemente Acest mic perioade Următoarele două - .. Perioadele mari, a treia și a patra între un metal alcalin și un gaz inert, este dispus pe 18 elemente în a treia perioadă de ridicat - 32 elemente în ultima perioadă, incomplete, - 6 elemente.
"Perioadele mari diferă de cele mici, nu numai prin faptul că ele au un număr mai mare de elemente, ci și pentru că majoritatea elementelor din ele sunt metale și numai la sfârșitul lor există metaloide.
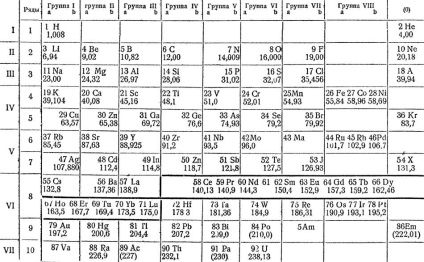
Sistem periodic de elemente conform lui DI Mendeleev
„Perioade mari, cât și cele mici, începe metale viguroase similare cu litiu și sodiu, dar apoi scade în proprietățile metalelor și creșterea metaloid este lent, și numai la sfârșit acolo metaloide. Cu toate acestea, există o proprietate în perioadele lungi peste care fiecare epocă majoră poate fi împărțită în două părți corespunzătoare perioadelor mici. Acest superior valența oxizi de formare a sării.
„Dacă urmărim schimbarea valența elementelor perioade lungi de oxigen, constatăm că la început, acest valența a crescut de la unu la șapte, și apoi există trei foarte similar cu un alt element de același valență - opt, și apoi o valență cade la unul, și apoi crește din nou până la șapte, după care scade la zero.
"Astfel, se pare că este posibil să se pună elemente de perioade mari sub elementele unor perioade mici, care au o valență corespunzătoare, rezultând că se obțin coloane de elemente cu aceeași valență.
"Există 10 rânduri în masă, cu doar cele două elemente mai ușoare din primul rând - hidrogen și heliu.
"Fiecare cifră a elementului este precedată de o cifră, care este numerotarea elementelor în ordine, în care urmează unul după celălalt, numerele de ordine." Numele elementelor conțin greutăți atomice.
„Elementele în formă de tabel 9 coloane sau grupuri de elemente cu aceeași valență ultima grupă -. Grupa de gaze inerte, care nu intenționează compus care posedă“ zerovalent „denota zero, - grupa zero“.
„In partea de jos a tabelului sunt tipurile corespunzătoare elementelor de grupe superioare de oxizi de formare a sării, cu ea în schimb elementul plasat marca litera R, nu un simbol al oricărui element particular. Următoarele sunt tipuri de compuși cu hidrogen gazos superior cunoscute doar IV-VII grupe. După cum se vede din acestea formulele tipice valența elementelor hidrogen, cu creșterea greutății atomice, scade în rândurile orizontale. de exemplu, clor, oxigen heptad formează un compus de tip hidrogen RH, și anume acid clorhidric. Există clor Trebuie remarcat faptul că suma valențelor pentru oxigen și hidrogen este constantă și egală cu 8 ".
„Când Mendeleev a întocmit un tabel de elemente, periodice ghidat de lege, el a fost conștient de doar 64 de elemente, în timp ce știm acum 92 de elemente. Prin urmare, au existat multe locuri goale din tabelul periodic, precum și de modul în care, în cazul în care stau acum elementele scandiu Sc (4- rândul st III c.), galiu Ga (5 rândul III c.) și germaniu Ge (5 rândul IV c.).
„La acel moment, elementele relevante nu au fost încă cunoscute, iar celelalte elemente apropiate în greutate atomică, nu a putut sa ia aceste locuri pentru că nu le apropie în proprietățile și conexiunile lor de tip. În baza legii periodice, Mendeleev în 1871, și-a exprimat convingerea că trebuie să existe elemente, dintre care locațiile sunt indicate de aceste intervale.
„Pe baza cunoașterii precise a proprietăților elementelor dispuse lângă aceste spații în direcții verticale și orizontale, Mendeleev identificat deja valori posibile ale greutăților atomice ale elementelor, și au proprietățile pe care trebuie să le aibă ele însele aceste elemente sub formă de substanțe simple ce conexiuni acestea ar putea forma și ce proprietăți acești compuși trebuie să fie diferite. predicțiile Mendeleev cu acuratețe completă a confirmat. elementele lipsă au fost descoperite în timpul duratei de viață periodică „[41].
predictia posibilitatea de a deschide noi elemente cu proprietățile lor Mendeleev este adesea comparat cu alte scopuri științifice „vizionare la distanță“ - astronomului Le Verrier cu predicția existenței unei planete necunoscute în sistemul nostru solar. Într-adevăr, o astfel de planetă numită Neptun a fost descoperit. Se spune adesea că Le Verrier a descoperit Neptun „pe vârful stiloului său.“ Cu drept egal se poate spune despre Mendeleev, el a deschis pen-ul său toate în fața lui, nu elemente cunoscute anterior.
Vedere modernă asupra structurii materiei
Mendeleev, potrivit datelor științifice ale timpului său, a considerat că atomul nu este descompus în nici o parte constitutivă și că are o greutate constantă care caracterizează proprietățile unui anumit tip de materie - acest element sau element chimic.
Cele mai recente realizări ale fizicii au arătat eroarea acestui punct de vedere.
Atomul nu este limita divizării materiei. Se compune dintr-un nucleu central și de electroni din jur. Compoziția nucleelor atomice la rândul lor este complicată. Ele sunt încărcate pozitiv, iar electronii externi din jur sunt negativi. Proprietățile chimice ale atomului depind de numărul de electroni exterioare, și greutatea atomică a - numărul de protoni nuclee. Studii recente au demonstrat că greutatea atomică, de exemplu, clor, nu pentru că este egal cu 35.456 ca atomul de clor de la 35.456 de ori mai greu decât un atom de hidrogen, și pentru că în clor, ori de câte ori se poate obține, întotdeauna avem un amestec de atomi cu greutate atomică 35 și 36 de ori mai mari decât greutatea atomică a hidrogenului într-o anumită relație una cu cealaltă. Ambele au 17 electroni externi și, prin urmare, nu diferă în ceea ce privește proprietățile chimice. Astfel de atomi identici în numărul de electroni având o greutate atomică diferită se numesc izotopi (în picioare, în același loc din tabelul periodic). De aici consecința că proprietățile elementelor depind de numărul lor atomic din tabelul periodic, în timp ce-l la dependența periodică care a fost specificată de Mendeleev.
Cele mai recente realizări ale științei nu au zdruncinat legea periodică a marelui chimist, ci au rafinat și l-au dezvoltat.
Lista elementelor cele mai utilizate în inginerie
Hidrogen (H). Pentru a umple balonul, pentru reacțiile de reducere, pentru uleiul de cracare în sine, adică. E. Separat de produsele sale scăzute de distilare cazan, hidrogenarea combustibil solid ( „ulei sintetic“ din cărbune), hidrogenarea grăsimilor lichide la solide.
Heliu (El). Pentru umplerea aeronavelor (nu este inflamabil!) Și lămpile cu gaz (strălucește cu lumină roșie, penetrează prin ceață).
Argon (Ar), Neon (Ne) și Kripton (Kr). Pentru lămpile cu descărcare în gaz.
Carbon (C). Sub formă de cărbune - drept combustibil; sub formă de creuzete grafit, lubrifiant uscat, creioane, vopsele; sub formă de diamant - pentru tăierea sticlei, pentru vârfurile de găurire, pentru șlefuire. În numeroși compuși există o varietate de aplicații. De exemplu, în compuși cu hidrogen, cum ar fi gaze ușoare, combustibili gazoși și lichizi.
Azot (N). Lămpi cu gaz, nitrizarea oțelului, în sinteza amoniacului și a compușilor cu azot. Compușii: substanțe explozive, îngrășăminte, vopsele, substanțe alimentare (așa-numita proteină).
Oxigenul (O). Sudare automată într-un amestec cu hidrogen și alte gaze combustibile, acid oxilic exploziv într-un amestec cu praf de cărbune, pentru respirația în submarine și în gondolele baloanelor stratosfere. În compușii cu metale - minereuri de oxigen, vopsele, oxizi, diverse aplicații în producția chimică și metalurgie.
Siliciu (Si). Împreună cu oxigenul (silice); sticlă de cuarț, pentru construcții (nisip), în ceramică, în producția de sticlă, pentru echipamente chimice, în inginerie electrică (izolatoare), producția de ciment, beton etc.
Fosfor (P). Meciuri, îngrășăminte, substanțe otrăvitoare, aliaj cu cupru (bronz fosfor).
Arsenic (As). Substanțe otrăvitoare, vopsele, medicamente.
Antimoniu (Sb). Aliaje, vopsele.
Bismut (Bi). Aliaje de aliaje, vopsele, medicamente, ceramica.
Sulf (S). Acid sulfuric, vopsele sulfuroase, insectotoxine (substanțe care otrăvesc insecte și dăunători în general).
Seleniu (Se). În inginerie electrică (își schimbă conductivitatea electrică în funcție de gradul de iluminare, de aici a fost folosit anterior în dispozitive TV, etc.).
Fluor (F). Pentru gravarea sticlei, în electrotehnică, în ceramică, în metalurgie.
Clor (Cl). Albire, dezinfecție, substanțe otrăvitoare, vopsele.
Brom (Br). Vopsele, medicamente.
Iod (I). Medicamente, vopsele.
Sodiu (Na) și potasiu (K). În fotocelule, sub formă de săruri în industria chimică, în medicină, în îngrășăminte (săruri).
Cupru (Cu). Aplicarea este bine cunoscută, în compuși - vopsele.
Argint (Ag) și Aur (Au). Aplicarea este bine cunoscută, în compuși - în producția de fotografie și de sticlă.
Magneziu (Mg). Pentru iluminat, în compuși (magneziti) din industria construcțiilor, în aliaje pentru metale ușoare.
Calciu (Ca). Sub formă de var și calcar în industria construcțiilor, în îngrășăminte, în industria chimică etc.
Bariu (Ba). Pentru alb.
Mercur (Hg). Vopsele, medicamente, în tehnologie.
Aluminiu (Al). În forma sa pură, un aditiv la oțel și aliaje în construcția de avioane și construcția de mașini, în compuși pentru purificarea apei (alum), în vopsire, în industria chimică, în industria petrolieră etc.
Tin (Sn). Poduri, lipire, aliaje de topire scăzută, în compuși din ceramică și vopsire (alb).
Plumb (PI). Instalatii sanitare, echipamente chimice, tipografice si aliaje cu topire scazuta, in compozitia vopselelor (pete pentru colorarea produselor metalice, albe).
Crom (Cr). Pentru cromarea metalelor, pentru fabricarea cromului și a oțelului inoxidabil, în compuși în vopsire și ca oxidant (anhidridă cromică) în industria chimică.
Tungsten (W). În inginerie electrică (fire de lămpi), în metalurgie pentru aliaje superhardice.
Mangan (Mn). Un aditiv la oțel, oferind rezistență excepțională, la compușii din industria vopsitoriei, ca un dezinfectant.
Fier (Fe). Aplicarea sub formă de fontă (aliaj de fier cu carbon și alți aditivi) și diferite grade de oțel este bine cunoscută în compușii din industria vopsitoriei, ca anectectoxină, în medicină.
Nichel (Ni). Pentru nikkelirovaniya, un aditiv la oțel pentru a crește vâscozitatea, la compușii din industria de vopsire și pentru fabricarea vopselelor.
Cobalt (Co). Recent, pentru cobalt (acoperiri cu un strat de cobalt de alte metale), în compuși - ca vopsele, pentru producția de oțel special.
Platină (Pt). Echipamente chimice și articole de sticlă de laborator, în inginerie electrică, compuși în fotografie. Spuma de platină în industria chimică, ca absorbant (substanță care se îngroașează pe suprafața gazului).
Comentarii:
În sensul obișnuit, nu chimic în mod specific al cuvântului.
La rata de chimie anorganice V. Ipatyev și A. Sapozhnikov