În problemele asociate cu adăugarea unei anumite cantități de solvent sau solut într-o soluție, este mai întâi necesar să se calculeze masa soluției dizolvate în soluția inițială și apoi să se folosească pentru calcule ulterioare. Starea fiecărei probleme pentru o mai bună vizibilitate este mai bine reprezentată sub forma unei imagini.
Sarcina 1.
La 180,0 g de soluție de clorură de sodiu 8% s-au adăugat 20 g de NaCI. Fracția de masă a clorurii de sodiu în soluția rezultată este. % (scrieți numărul la cea mai apropiată zecimală).
având în vedere:
masa soluției inițiale: misc.r-ra = 180 g;
Fracțiunea de masă a NaCl în soluția inițială: (NaCl) în ex-p = 8%;
masa de sare adăugată de NaCI: m (NaCI) adăugată = 20 g.
Caută:
fracția de masă a sării în soluția finală: (NaCl) în con / p-re
soluţie:
Starea problemei este afișată convenabil sub forma unei imagini:
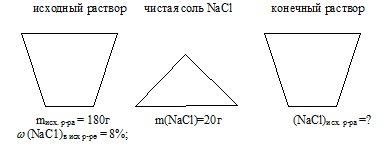
1. Se găsește masa de NaCl în soluția inițială:
2. Masa NaCl în soluția finală este suma:
m (NaCI) în cpp = m (NaCI) la ref. se adaugă p.re + m (NaCI). = 14,4 + 20 = 34,4 g.
3. Masa sării adăugate este, de asemenea, luată în considerare în masa soluției finale:
mkon. p-ra = mex. se adaugă p-ra + m (NaCI). = 180 + 20 = 200 g.
4. Datele obținute permit determinarea fracțiunii de masă din soluția finală:
Problema în care se adaugă puțină apă la o porțiune dintr-o soluție cu o concentrație cunoscută este rezolvată de același algoritm.
În problema amestecării a două soluții, este necesar un număr mai mic de calcule. În acest caz, este necesar să se calculeze masa substanței dizolvate în fiecare dintre cele
soluții inițiale.
Sarcina 2.
200 g dintr-o soluție de NaOH 20% au fost amestecate cu 218 ml dintr-o soluție 10% din aceeași substanță (p = 1,11 g / ml). Fracția de masă a alcalinilor în soluția rezultată. % (Scrieți numărul la cea mai apropiată zecimală).
având în vedere:
masa primei soluții de NaOH: m1 ex-ra = 200 g;
Fracțiunea de masă a NaOH în primul p-re: ω (MaOH) în 1 ex-p-re = 20%;
volumul celei de-a doua soluții de NaOH: V2exp.pa = 218 ml;
Fracțiunea de masă a NaOH în al doilea p-re: (NaOH) în 2 prize. p-r = 10%;
densitatea celei de-a doua soluții inițiale: p2 ex. r.p. = 1,11 g / ml.
Găsiți: fracția de masă a NaOH în p-re final: (NaOH) în con-pre
soluţie:
Starea problemei este afișată convenabil sub forma unei imagini:
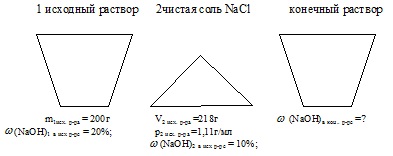
Atunci când se rezolvă această problemă, este necesar să se determine masa NaOH în fiecare dintre soluțiile inițiale. Apoi, găsiți masa totală a soluției finale și masa de NaOH în ea. După aceea, calculați valoarea necesară.
Schematic, algoritmul de soluție poate fi exprimat după cum urmează:
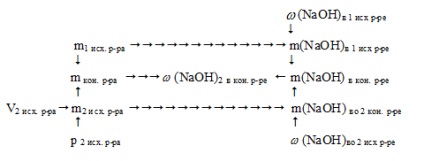
1. Se găsește masa de NaOH în prima soluție inițială:
2. Observăm masa celei de-a doua soluții inițiale:
m2 out. p-pa = V2 ref. p-pa. p 2 out. p-pa = 218. 1,11 = 242 g.
3. Se găsește masa de NaOH în a doua soluție inițială:
m (NaOH) la sfârșit. p-re = m (NaOH) în 1 ref. p-re + m (NaOH) în 2 prize. p-re = 40 + 24,2 = 64,2 g.
5. Se găsește masa soluției finale:
mkon. p-ra = m1 afară. p-p a + m2 ref. p-ra = 200 + 242 = 442 g.
6. Se găsește fracția de masă de NaOH în soluția finală:
Contorizăm valoarea obținută la zeci.
Răspunsul este: (NaOH) în conc. Re-re = 14,5%.
În problema evaporării, greutatea soluției este redusă, de obicei, prin îndepărtarea solventului. Masa substanței dizolvate rămâne aceeași, ceea ce duce la o creștere a concentrației.
Sarcina 3.
Determinați masa de apă care trebuie evaporată din 2 litri dintr-o soluție de NaOH 10% (p = 1,11 g / ml) pentru a crește fracțiunea de masă a NaOH în acesta la 15%. Răspuns. r (scrieți numărul la cel mai apropiat număr întreg).
având în vedere:
volumul soluției inițiale: Vic. p-pa = 2 litri;
densitatea soluției inițiale: orez p-ra = 1,11 g / ml;
Fracțiunea de masă a NaOH în p-re inițial: (NaOH) în Ref. P = 10%;
fracția de masă a NaOH în p-re final: (NaOH) în con-pe = 15%
Găsiți: masa de apă evaporată: m (H20) evaporată =?
soluţie:
Când soluția apoasă de NaOH este evaporată, numai apa se va evapora. Greutatea NaOH va fi aceeași în ambele soluții inițiale și finale.
Schematic, algoritmul de soluție poate fi reprezentat după cum urmează:
1. Să găsim masa soluției inițiale:
2. Să găsim masa de NaOH în soluția inițială:
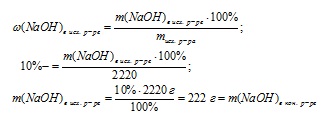
3. Se determină masa soluției finale:
4. Scăderea în masă a soluției a avut loc numai datorită evaporării apei, prin urmare, în funcție de diferența dintre masele soluțiilor inițiale și finale, se poate găsi o masă de apă volatilizată:
m (H20) evaporat = misc p-ra-mcon. p-ra = 2220-1480 = 740 g.
Răspuns: m (H20) evaporat = 740 g.
În anumite condiții, se propune eliminarea unei substanțe solide foarte volatile dintr-o soluție sub formă de gaz (de exemplu NH3, HCI, H2S sau materie organică dizolvată în apă). Pentru a rezolva astfel de probleme este necesar să se considere masa solventului (apă) neschimbată.
Sarcina 4.
Când au fost încălzite 200 g de soluție de amoniac 25%, 20 g din această substanță au fost volatilizate. Fracția de masă a amoniacului din soluție după încălzire este. % (scrieți numărul la cea mai apropiată zecimală).
având în vedere:
masa soluției inițiale: misc p-ra = 200 g;
fracția de masă a NH3 în soluția inițială: (NH3) în ref. p-r = 25%;
masa amoniacului volatilizat: m (NH3) scăpat = 20 g.
Găsiți: fracțiunea de masă a NH3 în p-re final: (NH3) la sfârșit. pre =?
soluţie:
Schematic, algoritmul de soluție poate fi reprezentat după cum urmează:
1. Se găsește masa de NH3 în soluția inițială:
2. Am găsit masa de NH3 în soluția finală:
Se găsește masa soluției finale 1:
4. Se găsește fracția de masă de amoniac în soluția finală:
Se rotunjește valoarea, în funcție de cerința condiției, și se obține: (NH3) la sfârșit. p-r = 16,7%.
Răspuns: (NH3) la sfârșit. p-r = 16,7%.
- Sunteți aici:
- principal
- sarcini
- EGE-chimie
- Determinarea fracțiunii de masă și molară a fiecărei sări din amestec Sarcini 33-34