Densitatea amoniacului și alte proprietăți fizice
În condiții normale, amoniacul este un gaz incolor, cu un miros asfixios ascuțit. Densitatea amoniacului este de 0,73 kg / m3.
Molecula de amoniac are o compoziție chimică care este reflectată de formula NH3. Are forma unei piramide trigonala (DNH = 0,10nm, HNH unghiul 0 = 107,3) (Fig. 1). Conform teoriei legătură de valență întâlnește sp3 -hybridization valență atom de azot orbitali. Dintre cele patru orbitali sp 3 -Hybrid trei azot implicat în formarea a trei sigma legături N-H, iar al patrulea orbital ia pereche de electroni de legare. Din punct de vedere teoretic orbitale moleculare, aceasta corespunde pentru a umple trei lipire și un pic de legare moleculară sigma orbitali:
Deoarece norul nelegat de doi electroni este orientat în spațiu, molecula de amoniac este un donor pronunțat al perechii de electroni și are o polaritate mare (m = 0,49 x 10 -29 Cl × m).
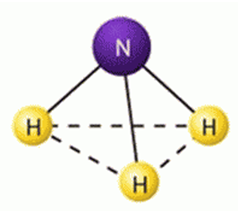
Fig. 1. Structura moleculei de amoniac.
Polaritatea legăturii N-H cauzează legătura de hidrogen dintre moleculele de amoniac. Prin urmare, punctele de topire (-77,8 ° C) și punctul de fierbere (-33,4 ° C) de amoniac sunt destul de ridicate; se caracterizează printr-o entalpie considerabilă de evaporare și este ușor lichefiată.
Amoniacul lichid, ca apa, este un solvent puternic ionizant. În acest caz, derivații NH4 + în amoniac lichid se comportă ca acizi (aminoacizi) și derivați de NH2 - ca baze (amonobază). De exemplu, acizii puternici în amoniac lichid sunt NH4CI, NH4N03. iar bazele sunt KNH2. Ba (NH2) 2. Dihidronitridele Zn (NH2) 2. Al (NH2) 3 se comportă ca compuși amfoterici.
Amoniacul este foarte solubil în apă (la 20 ° C într-un volum de apă se dizolvă aproximativ 700 de volume de amoniac). Solubilitatea bună se datorează formării unei legături de hidrogen între moleculele NH3 și H2O.
Scurtă descriere a proprietăților chimice și a densității amoniacului
Amoniacul este foarte reactiv, este predispus la reacții prisoedineniya.Sgoraet oxigen reacționează cu acizi, metale, halogeni, oxizi și halogenuri.
2NH3 + 2Al = 2AlN + 3H2 (peste t = 600 ° C).
Reacția calitativă la amoniac - înnegrirea unei hârtii umezite cu o soluție de Hg2 (NO3) 2 (formarea de mercur). Amoniacul este deshidratat cu oxid de calciu.
Amoniacul lichid este principalul solvent protonic; dizolvă ușor sulful, halogenurile (cu excepția fluorurilor) și nitrații de metale alcaline, amoniu halogenat, permanganat de potasiu; slab dizolvă fluorurile anorganice, sulfații, carbonații.
Exemple de rezolvare a problemelor
Se calculează masa molară a gazului, a cărui densitate în aer este de 0,756.
Raportul dintre masa gazului la masa altui gaz luate în aceeași cantitate, la aceeași temperatură și aceeași presiune, este numită densitatea relativă a primului gaz în al doilea. Această valoare arată de câte ori primul gaz este mai greu sau mai ușor decât al doilea gaz.
Masa moleculară relativă a aerului este egală cu 29 (luând în considerare conținutul de azot, oxigen și alte gaze din aer). Trebuie remarcat faptul că termenul "masa moleculară relativă a aerului" este utilizat condiționat, deoarece aerul este un amestec de gaze.
Dair (gaz) = M (gaz) / M (aer);
M (gaz) = M (aer) × Dair (gaz);
M (gaz) = 29 x 0,756 = 22 g / mol.
Masa molară a gazului este de 22 g / mol.
Determinați masa molară a gazului necunoscut dacă volumele egale ale acestui gaz și oxigenului în aceleași condiții au o masă de 4,15 g și 0,32 g.
Raportul dintre masa gazului la masa altui gaz luate în aceeași cantitate, la aceeași temperatură și aceeași presiune, este numită densitatea relativă a primului gaz în al doilea. Această valoare arată de câte ori primul gaz este mai greu sau mai ușor decât al doilea gaz.
Masa moleculară a hidrogenului este:
Apoi, masa molară a gazului necunoscut
M (gaz) = M (02) × DO2 (gaz) = 32 × 1,328 = 42,5 g / mol.