Ce păstrează un electron într-un atom din orbita unui nucleu atomic?
La prima vedere, mai ales dacă te uiți la versiunea de desene animate a atomului descris de mine mai devreme, cu toate neajunsurile sale, electronii se deplasează într-o orbită în jurul nucleului, arata exact ca o planetă se deplasează într-o orbită în jurul Soarelui. Și se pare că principiul acestor procese este același. Dar există o captură.
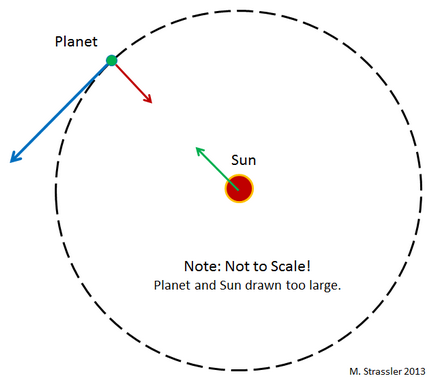
Ce păstrează planetele în orbită în jurul Soarelui? În gravitația newtoniană (complexul lui Einstein, dar aici nu avem nevoie) oricare doua obiecte sunt atrasi unul de celalalt printr-o interacțiune gravitațională, proporțională cu produsul maselor lor. În special, gravitatea trage planeta soare la aceasta (cu o forță invers proporțională cu pătratul distanța între acestea. Adică, dacă distanța este redusă la jumătate, puterea este crescut de patru ori). Planeta atrage de asemenea Soarele, dar este atat de grea incat aproape nu-i afecteaza miscarile.
Inerția, tendința obiectelor de a se deplasa de-a lungul liniilor drepte în absența altor forțe care acționează asupra lor, acționează împotriva atracției gravitaționale și, ca urmare, planetele se mișcă în jurul Soarelui. Acest lucru este văzut în figura 1, în care este prezentată o orbită circulară. De obicei, aceste orbite sunt eliptice - deși în cazul planetelor ele sunt aproape circulare, deoarece sistemul solar a fost format în acest fel. Pentru diverse pietre mici (asteroizi) și blocuri de gheață (comete) care se deplasează în orbite în jurul Soarelui, nu este așa.
În mod similar, toate perechile de obiecte încărcate electric sunt atrase sau respinse unul de celălalt, cu o forță și invers proporțională cu pătratul distanței dintre ele. Dar, spre deosebire de gravitate, care atrag mereu obiecte impreuna, fortele electrice pot atrage si respinge. Obiectele care au aceleași taxe pozitive sau negative resping. Un obiect încărcat negativ atrage un obiect încărcat pozitiv și invers. Prin urmare, expresia romantică "atrage contrariile".
Prin urmare, un nucleu atomic încărcat pozitiv în centrul unui atom este atras de electronii ușori care se deplasează pe marginea atomului către ei înșiși, aproximativ așa cum Soarele atrage planetele. Electronii atrag, de asemenea, nucleul, dar masa nucleelor este mult mai mare, încât atracția lor nu are aproape niciun efect asupra nucleului. Electronii se repetă, de asemenea, unul dintre motivele pentru care nu le place să-și petreacă timpul aproape unul de celălalt. S-ar putea presupune că electronii dintr-un atom se mișcă în orbite în jurul nucleului în același mod în care planetele se mișcă în jurul soarelui. Și la prima vedere, exact asta fac, mai ales într-un atom de desen animat.
Dar aici este truc: de fapt, aceasta este o captură dublă, și fiecare dintre cele două trucuri murdare are un efect opus celuilalt, ca urmare a faptului că ei distrug reciproc!
Tricou dublu: cum atomii diferă de sistemele planetare
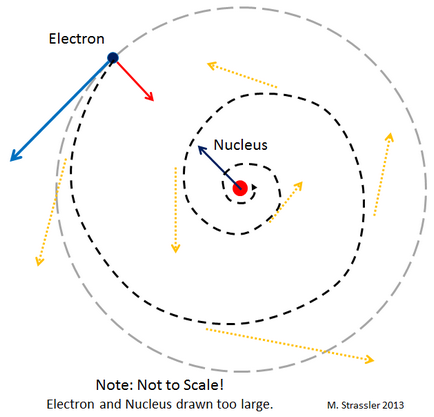
Primul truc: spre deosebire de planete, electronii care se deplasează în orbite în jurul nucleului ar trebui să emită lumină (mai precis undele electromagnetice, dintre care un exemplu este lumina). Și această radiație ar trebui să facă electronii să încetinească și să cadă pe miez într-o spirală. În principiu, în teoria lui Einstein există un efect similar - planetele pot emite valuri gravitaționale. Dar el este extrem de mic. Spre deosebire de cazul electronilor. Se pare că electronii din atom trebuie să curgă foarte repede, într-o mică fracțiune de secundă, pe miez într-o spirală!
Și ar fi făcut-o, dacă nu pentru mecanica cuantică. O catastrofă potențială este prezentată în Fig. 2.
Al doilea truc murdar: dar lumea noastră funcționează conform principiilor mecanicii cuantice! Și are propriul său principiu uimitor și contra-intuitiv de incertitudine. Acest principiu, care descrie faptul că electronii sunt aceleași valuri ca particulele, merită propriul lor articol. Dar iată ce trebuie să știm despre el pentru articolul de astăzi. O consecință generală a acestui principiu este că este imposibilă cunoașterea simultană a tuturor caracteristicilor unui obiect. Există seturi de caracteristici pentru care măsurarea uneia dintre ele face ca celelalte să fie nedefinite. Unul dintre cazuri este localizarea și viteza particulelor, cum ar fi electronii. Dacă știi exact unde e electronul, nu știi unde merge și invers. Puteți ajunge la un compromis și știți cu o anumită certitudine unde se află și, cu o anumită certitudine, știe unde se îndreaptă. În atom, așa se pare.
Să presupunem că un electron se află în spirală pe un nucleu, ca în Fig. 2. În procesul de cădere, vom fi din ce în ce mai conștienți de locația sa. Apoi, principiul incertitudinii ne spune că viteza sa va deveni tot mai incertă. Dar dacă electronul se oprește la bază, viteza lui nu va fi incertă! Prin urmare, el nu se poate opri. Dacă încearcă brusc să coboare o spirală, va trebui să se miște mai repede și mai repede la întâmplare. Și această creștere a vitezei va duce electronul departe de miez!
Deci, tendința de a cădea într-o spirală va fi neutralizată de tendința de mișcare mai rapidă în conformitate cu principiul incertitudinii. Balanța este atunci când electronul este localizat la distanța preferată de nucleu și această distanță determină dimensiunea atomilor!

Dacă electronul este inițial departe de nucleu, el se va deplasa spre el într-o spirală, așa cum se arată în Fig. 2 și emite unde electromagnetice. Dar, ca rezultat, distanța față de nucleu devine suficient de mică pentru ca principiul incertitudinii să interzică o apropiere ulterioară. În această etapă, atunci când vom găsi echilibrul între radiații și incertitudine, electronul organizează stabil „orbită“ în jurul nucleului (sau, mai degrabă, orbital - un termen ales pentru a sublinia faptul că, spre deosebire de planete, electronul din cauza mecanicii cuantice, nu există nici o astfel de orbite, care există planete). Raza orbitalilor determină raza atomului (Figura 3).
O altă caracteristică - apartenența electronilor la fermioane - obligă electronii să nu coboare pe o singură rază și să se alinieze de-a lungul orbitalilor de diferite raze.
Cât de mari sunt atomii? Abordare bazată pe principiul incertitudinii
De fapt, putem estima aproximativ mărimea atomului, folosind doar calculele pentru interacțiunile electromagnetice, masa electronului și principiul incertitudinii. Pentru simplitate, să facem calcule pentru atomul de hidrogen, unde nucleul constă dintr-un singur proton, în jurul căruia se mișcă un electron.
- Denumim masa unui electron
- Incertitudinea poziției electronului este notată cu Δx
- Incertitudinea vitezei electronilor este notată cu Δv
Principiul incertitudinii prevede:
$$ afișare $$ m_e (Δ v) (Δ x) ≥ ℏ $$ afișare $$
unde ℏ este constanta lui Planck h împărțită la 2 π. Observați că el (Δv) (Δx) nu poate fi prea mic, ceea ce înseamnă că ambele determinări nu pot fi prea mici, deși unul dintre ele poate fi foarte mic dacă celălalt este foarte mare.
Când atomul este instalat în starea de bază preferată, ne putem aștepta ca semnul ≥ să se transforme într-un semn
B înseamnă că "A și B nu sunt exact egale, dar nu sunt foarte diferite". Acesta este un simbol foarte util pentru rating!
Pentru atomul de hidrogen în starea fundamentală, în care incertitudinea poziției este aproximativ egal Ax cu raza unui atom R, iar incertitudinea vitezei este aproximativ egală Av cu viteza V a unei mișcări tipic de electroni în jurul atom, obținem:
Cum de a învăța R și V? Între ei și forța care ține atomul împreună, există o relație. În fizica non-cuantică, obiectul masic m, situat într-o orbită circulară de rază r, și deplasând cu viteza v în jurul obiectului central care îl atrage cu forța F, va satisface ecuația
Nu se aplică direct la un electron dintr-un atom, dar funcționează aproximativ. Forța care acționează în atom este forța electrică cu care un proton cu încărcătură +1 atrage un electron cu o sarcină de -1 și, ca rezultat, ecuația ia forma
unde k - Coulomb constantă, e - unitatea de încărcare, c - vitezei luminii, ℏ - h constanta lui Planck, împărțit la 2 π și α - definit ne structură fină constantă, egală. Combinăm cele două ecuații anterioare pentru F, iar raportul estimat este obținut după cum urmează:
Acum aplicăm acest lucru atomului, unde v → V, r → R și m → me. De asemenea, înmulțiți ecuația superioară cu. Aceasta oferă:
La ultimul pas am folosit relația noastră de incertitudine pentru atom ,. Acum putem calcula raza atomului R:
Și se dovedește a fi aproape exact! Astfel de evaluări simple nu vă vor da răspunsuri exacte, dar o aproximare foarte bună vă va asigura!