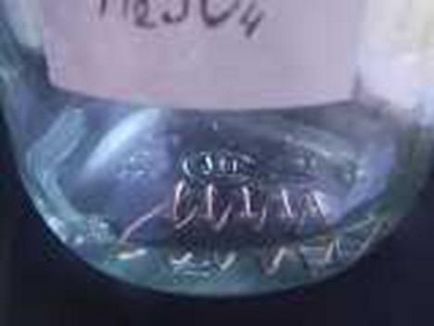Cupru. Simbolul elementului chimic Cu (lat. Cuprum, lat. Titlurile Cipru, unde grecii și romanii exportate din cupru), are un număr de ordine 29, greutate atomică de 63, 54, valența principală II, densitate 8, 9 g / cm 3. Temperatura punct de topire 1083 ° C, punct de fierbere 2600 ° C.
Ea era cunoscută în antichitate înainte de fier și a fost folosită, mai ales într-un aliaj cu alte metale, pentru arme și articole de uz casnic.
Cuprul, singurul metal care are o culoare roșiatică. Acest lucru îl distinge de toate celelalte metale.
Din punct de vedere chimic, cuprul este un metal slab activ. apă proaspătă curată și aerul uscat, practic, nu provoacă coroziunea cuprului, ci în aer, în prezența dioxidului de carbon, acesta este acoperit cu o peliculă verde (patină) carbonat de cupru gidrookisnyh Čuĉo 3. Cu (OH) 2. Atunci când încălzirea este formată pe o mătreață neagră suprafață metalică oxid de cupru CuO.
Ușoara influență asupra rezistenței chimice a cuprului au gaze uscate, un număr de acizi organici, alcooli și rășina fenolică la cupru carbon este pasiv. Cuprul are, de asemenea, rezistență bună la coroziune în apa de mare. În absența altor oxidanți, acizii sulfurici și acid clorhidric diluați nu acționează pe cupru. Cu toate acestea, în prezența cuprului oxigenului atmosferic se dizolvă în acești acizi pentru a forma săruri respective (în acid sulfuric pentru a forma sulfat de CUSO4; .. în acid clorhidric, pentru a forma clorura de cupru CuCI2) în cupru acid azotic se dizolvă, formând nitrat Cu (NO 3) 2.
Când interacționează cu acidul acetic, se formează acetatul principal de cupru - urechea cupru-cupru otrăvitoare.
Prin reacția în acid azotic, este posibilă verificarea aliajelor pentru cupru - dacă acidul a obținut o culoare albastru-verde, atunci cuprul este prezent în aliaj.
Cuprul slab rezistă acțiunii de amoniac, săruri de amoniac și compuși de cianură alcalină. Coroziunea de cupru este de asemenea cauzată de clorura de amoniu și acizii minerali oxidativi.
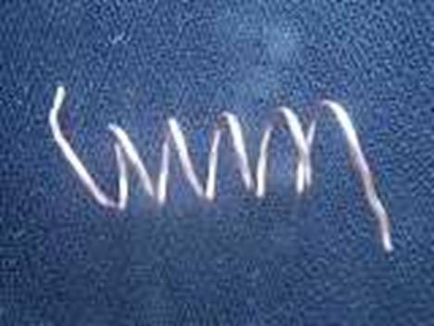
Fotografiile arată debutul reacțiilor la temperatura camerei.
Cuprul are o bună luciu și polisabilitate ridicată, dar strălucirea lui dispare destul de repede.
Acesta a fost utilizat pe scară largă în inginerie și industrie datorită unui număr de proprietăți valoroase pe care le posedă. Cele mai importante proprietăți ale cuprului sunt conductivitatea electrică și termică ridicată, ductilitate ridicată și capacitatea de a suferi o deformare plastică la rece și la cald, o bună rezistență la coroziune și capacitatea de a forma mai multe aliaje cu o gamă largă de proprietăți diferite. În ceea ce privește conductivitatea electrică și termică, cuprul este al doilea decât argintul. are o căldură specifică foarte mare. Cuprul este diamagnetic.
Mai mult de 50% din cuprul extras este utilizat în industria electrică (cupru pur); se utilizează aproximativ 30-40% cupru sub formă de aliaje de mare importanță (alamă, bronz, cupronicel, etc.). De exemplu, în fabricarea dispozitivelor semiconductoare care utilizează cupru pentru producerea de piese ale aparatului, în principal pini și suporturi cip (purtător cip - acest detaliu, care este armat direct semiconductor placă) dispozitive electrice și părți ale echipamentului de proces.
Conductivitatea termică bună a cuprului, rezistența sa ridicată la coroziune fac posibilă utilizarea acestui metal pentru producerea de diferite schimbătoare de căldură, conducte și altele asemenea. De exemplu, bazinele de cupru asigură o încălzire uniformă atunci când se gătește gem.
Cele mai importante săruri ale cuprului:
- Sulfatul de cupru CuSO4 în stare anhidră este o pulbere albă care, atunci când apa este absorbită, devine albastră și, prin urmare, soluția apoasă de sulfat dobândește o culoare albastru-albastru. Din soluțiile apoase, sulfatul de cupru cristalizează cu cinci molecule de apă, formând cristale transparente albastre. În această formă se numește vitriol de cupru;
- clorura de cupru CuCI2 2H2O formează cristale verde închis, ușor solubile în apă;
- Azotul de cupru Cu (NO3) 2. 3H20 este obținut prin dizolvarea cuprului în acid azotic. Când sunt încălzite, cristalele de cupru pierd mai întâi apa și apoi se descompun prin eliberarea oxigenului și a dioxidului de azot maro, trecând în oxid de cupru;
- acetatul de cupru Cu (CH3COOO) 2. H20 este obținut prin tratarea cuprului sau a oxidului său cu acid acetic. Sub numele yary-medyanka se folosește pentru prepararea vopselelor cu ulei;
- amestecul de cupru acetat-arzeniți Cu (CH3COO) 2. Cu 3 (AsO3) 2 se folosește sub numele de verde Paris pentru distrugerea dăunătorilor plantelor.
Sarurile de cupru produc o cantitate mare de vopsele minerale, diferite de culoare: verde, albastru, maro, violet, negru.
Toate sărurile cuprului sunt otrăvitoare, așa că ustensilele din cupru sunt conservate (acoperite cu un strat de staniu) pentru a preveni formarea de săruri de cupru.
Cuprul este unul dintre microelementele vitale. Această denumire a fost dată Fe, Cu, Mn, Mo, B, Zn, Co, datorită faptului că cantitățile mici sunt necesare pentru viața normală a plantelor. Microelementele cresc activitatea enzimelor, promovează sinteza zahărului, amidonului, proteinelor, acizilor nucleici, vitaminelor și enzimelor. Cel mai adesea cuprul este introdus în sol sub formă de sulfat de cupru. În cantități semnificative, este toxic, ca mulți alți compuși ai cuprului, iar în doze mici cuprul este necesar pentru toate lucrurile vii.
În cuprul tehnic, impuritățile conțin: bismut, antimoniu, arsenic, fier, nichel. plumb. staniu. sulf, oxigen, zinc și altele. Toate impuritățile din cupru reduc conductivitatea electrică. Punctul de topire, densitatea, plasticitatea și alte proprietăți ale cuprului variază semnificativ de la prezența impurităților în acesta.
Bismut și plumb în aliaje de cupru formează un eutectic cu punct de topire scăzut (din eutektos greacă - un aliaj cu un punct de topire sub punctele de topire ale componentelor sale constitutive, în cazul în care acesta din urmă nu formează împreună un compus chimic), care după cristalizare se solidifică ultimul și aranjate de-a lungul limitelor au renunțat anterior la granule de cupru (cristale). Atunci când este încălzit la temperaturi peste punctul de topire al eutectică (270 și 327 ° C, respectiv), granule de cupru sunt separate eutectic lichid. Un astfel de aliaj este roșiatic și este distrus în timpul laminării la cald. Friabilitatea de cupru poate fi cauzată de prezența în ea thousandths unui bismut la sută și sutimi de plumb la sută. Cu un conținut crescut de bismut și plumb, cuprul devine fragil în stare rece.
Forma de sulf și oxigen cu eutectici refractare din cupru cu puncte de topire deasupra temperaturilor de lucru la cald ale cuprului (1065 și 1067 ° C). Prin urmare, prezența unor cantități mici de sulf și oxigen în cupru nu este însoțită de apariția roșeaței. Cu toate acestea, o creștere semnificativă a conținutului de oxigen conduce la o scădere semnificativă a proprietăților mecanice, tehnologice și corozive ale cuprului; cuprul devine roșu și rece.
Cuprul care conține oxigen, când este recoace în hidrogen sau într-o atmosferă care conține hidrogen, devine fragilă și crăpată. Acest fenomen este cunoscut sub numele de "boala de hidrogen". Cuprul de cracare în acest caz are loc ca urmare a formării unei cantități semnificative de vapori de apă în timpul interacțiunii hidrogenului cu oxigenul de cupru. Vaporii de apă la temperaturi ridicate au presiune ridicată și distrug cuprul. Prezența fisurilor în cupru se stabilește prin încercări de îndoire și torsiune, precum și prin metoda microscopică. În cupru, afectat de boala de hidrogen, după lustruirea incluziunilor vizibile și întunecate de pori și fisuri.
Sulful reduce plasticitatea cuprului în timpul funcționării la rece și la cald cu presiune și îmbunătățește prelucrabilitatea prin tăiere.
Fierul se dizolvă în cupru într-o stare solidă foarte nesemnificativ. Sub influența impurităților de fier, conductivitatea electrică și termică a cuprului și rezistența la coroziune sunt reduse drastic. Structura cuprului sub influența impurităților de fier este zdrobită, ceea ce sporește rezistența și reduce plasticitatea. Sub influența fierului, cuprul devine magnetic.
Beriliul este un deoxidator în raport cu cuprul, reduce într-o oarecare măsură conductivitatea sa electrică, crește proprietățile mecanice și reduce semnificativ oxidarea la temperaturi ridicate.
Fosforul reduce foarte mult conductivitatea electrică și termică a cuprului, dar afectează în mod pozitiv proprietățile sale mecanice și fluiditatea. Fosforul este utilizat pe scară largă în industria de turnătorie ca un deoxidant de cupru și are un efect pozitiv asupra sudării cuprului.
Aluminiu îmbunătățește rezistența la coroziune și reduce oxidarea cuprului la temperaturi normale și ridicate, reduce în mod semnificativ conductivitatea sa electrică și termică și are, de asemenea, un efect negativ asupra lipirii și cositorării produselor din cupru. Impuritatea aluminiului nu exercită o influență vizibilă asupra proprietăților mecanice și a prelucrării cuprului cu presiune. Solubilitatea aluminiului în cupru în stare solidă este de 9,6%.