Numărul pacienților cu imunosupresie este în continuă creștere, care se datorează:
O proprietate unificatoare a diferitelor populații de pacienți în acest caz este susceptibilitatea lor crescută la diferiți agenți infecțioși, ceea ce se explică prin scăderea valorilor pragului de virulență [1, 6]. Deteriorarea țesutului pulmonar, atât infecțioasă, cât și neinfecțioasă, este probabil cea mai frecvent descrisă patologie în rândul pacienților cu diferite afectări ale imunității. Mai mult, infecția pulmonară ocupă o poziție de lider în rândul tuturor infecțiilor invazive, care sunt diagnosticate la astfel de pacienți [6, 9, 10].
Un pacient cu tulburări de imunitate, pe de o parte, este expus în mod constant agenților patogeni de mediu și, pe de altă parte, prezența unui defect de imunitate care determină tipul de infecție pulmonară care se dezvoltă. La acești pacienți, cele mai frecvente cauze ale dezvoltării unui UDI sunt: infecția nosocomială, adesea rezistentă la antibiotice; expunerea la factorii de mediu (infecția aeriană și / sau infecția transmisă prin intermediul apei potabile); infecția, pragul de virulență este ridicat în rândul populației; reactivarea infecțiilor transmise anterior (de exemplu, tuberculoza) [10, 12].
Care sunt principalele caracteristici ale infecțiilor respiratorii la pacienții cu imunitate redusă, a căror cunoaștere contribuie la recunoașterea la timp și începe să efectueze un tratament terapeutic adecvat, cât mai curând posibil.
- Atunci când se detectează întuneric nesemnificativ al țesutului pulmonar în cursul unei examinări radiografice de rutină a toracelui (OGC), o tomografie computerizată a WGC trebuie prescrisă în acest grup de pacienți.
- În cazul unei infiltrări pulmonare multifocale infecțioase (virale, bacteriene sau fungice) etiologie, natura infecțioasă, și este suspectat de a efectua radiografie OGC metastaze tesutului pulmonar in combinatie cu studiul sputa nu poate fi o procedură de diagnosticare adecvată din cauza productivității scăzute.
- Diagnosticul serologic este, de obicei, puțin informativ la acești pacienți, în organismul cărora producerea în timp util a anticorpilor ca răspuns la infecție nu este generată; Prin urmare, sunt adesea folosite metode bazate pe determinarea antigenului și / sau reacțiile în lanț ADN polimerază (PCR).
- Execuția în cel mai scurt timp calculat de cercetare pulmonara tomografică, precum stadializarea diagnostic patologic (pe baza studiilor histologice și cultură au primit probe de tesuturi si tampoane din trahee și bronhii) crește foarte mult supraviețuirea pacienților din acest grup.
- Țesutul pulmonar poate avea loc simultan mai multe procese, în special în prezența unei infecții a unuia sau mai multor agenți patogeni (Pneumocystis sarinii / jiroveci. Citomegalovirus (CMV) și așa mai departe. D.). Suprainfecție adesea detectate pe fluxul de fond a altor procese (de exemplu, pe fondul sindromului de detresă respiratorie acută (ARDS) sau distrugerea de droguri a tesutului pulmonar).
- Utilizarea regimurilor prescurtate de chimioterapie imunosupresoare prescrise (în special corticosteroizi) poate fi la fel de importantă ca factor de risc pentru infecție ca și tratamentul antibiotic prescris.
- bacterii tipice - 37%;
- ciuperci - 12%;
- viruși - 15%;
- Pneumocystis carinii / jiroveci - 8%;
- Nocardia asteroizi - 7%;
- Mycobacterium tuberculosis - 1%;
- infecție mixtă - 20%.
Destul de des, la o populație de pacienți cu neutropenie [11, 12] având infecție mixtă, care se bazează pe: virusul infecțiilor respiratorii sentitsialnogo sau CMV sau invazia de Aspergillus spp. în combinație cu flora gram-negativă sau cu P. carinii / jiroveci. Pneumocystis ca monoinfection și / sau infecție mixtă este cel mai frecvent descrisă la pacienții care primesc tratament sistemic cu corticosteroizi (acest lucru se aplică ambelor tipuri de cursuri pe termen lung a monoterapiei cu corticosteroizi și utilizarea lor ca parte a regimului de chimioterapie la pacientii cu cancer sprijini).
În literatura modernă este descrisă o creștere a numărului de leziuni fungice și a fluxului lor torpid la pacienții cu imunitate scăzută, în ciuda utilizării noilor agenți antifungici [8, 11, 12]. În prezent, cele mai relevante sunt trei agenți infecțioși care cauzează modificări pulmonare: Pneumocystis carinii / jirovici. reprezentanți ai genului Aspergillus (în special A. fumigatus) și Cryptococcus neoformans [12, 14].
Taxonomic, pneumocistul este clasificat drept ciupercă. La începutul noului mileniu de tip Pneumocystis carinii. provocând infecții la om, a fost izolat într-un fel separat de Pneumocystis jiroveci - în onoarea de om de știință ceh Otto JÍROVEC parasitologist primul care a descris acest organism ca o cauza a bolii la om.
P. jiroveci. este un parazit extracelular cu tropism preferențial pentru țesutul pulmonar, afectează pneumocitele de 1 și ordinul 2. Dificultăți în diagnosticul diferențial în caz de suspiciune de dezvoltare a pneumoniei Pneumocystis carinii la un pacient (PP), se explică în principal prin faptul că examinarea standard a pacienților cu puține informații, până la 20% dintre ei au uzat clinica, si de examinare cu raze X dezvaluie nici o patologie. Primele semne ale unui PP în curs de dezvoltare sunt în creștere lent hipoxemie, dispnee și tuse numărul mic de date la examenul fizic și manifestările radiografice.
Trei etape ale bolii se deosebesc de pozițiile clinice.
- Etapa edematoasă, cu o durată medie de 7-10 zile, se caracterizează prin dispnee în creștere înceată, care progresează constant până la dispnee pronunțată în repaus și este însoțită de o tuse uscată, neproductivă. În plămâni, respirația nu este auzită, respirația este de obicei slăbită. Simptomele intoxicației generale sunt nesemnificative (starea de subfebrilă, slăbiciunea generală). Imaginea radiologică la începutul bolii este neclară, deseori descrisă ca o variantă a normei; mai puțin evidentă este o scădere radicală a pneumatizării țesutului pulmonar și o creștere a modelului interstițial.
- Pentru atelektaticheskoy etapa (durata de aproximativ 4 săptămâni) se caracterizează prin dispnee severă de repaus (30-50 respirații pe 1 min), pacienții în cauză tuse neproductivă cu mucus vâscos, adesea descris în piept umflarea. Există deseori febră febrilă. Imaginea auscultatorie se caracterizează prin respirație severă și / sau slăbită (local sau pe întreaga suprafață a plămânilor), uneori sunt auzite raele uscate. În etapele ulterioare ale imaginii clinice a bolii, simptomele insuficienței respiratorii și cardiovasculare au ajuns în prim plan. Radiologi la acest punct mai mult de jumătate din detectat-nor infiltrate bilaterale (simptom „fluture“), și - abundent umbra focala (plămân „căptușit“).
- Ultima etapă a emfizemului se caracterizează prin dezvoltarea de umflături lombulare emfizematoase și, eventual, prin distrugerea septei alveolare cu dezvoltarea pneumotoraxului. Din punct de vedere clinic, poate exista o anumită îmbunătățire a stării pacienților, o reducere a dispneei.
Măsuri de diagnosticare care vizează detectarea Pneumocystis jiroveci. începeți cu producerea sputei induse. Materialul a fost examinat prin microscopie directă a frotiurilor colorate. Recent, pentru un diagnostic mai precis, metoda PCR, metodele imunofluorescente cu anticorpi mono- și policlonali au fost dezvoltate și aplicate. Bronhoscopie cu lavaj bronhoalveolar in asociere cu biopsie transbronsica permite aproape 100% din agentul patogen detectat și, prin urmare, este metoda cea mai eficientă și fiabilă pentru diagnosticarea PP. În acele cazuri în care pacienții au recurs la tratamentul cu pentamidină, eficiența diagnosticului utilizând lavajul bronhoalveolar a fost redusă la 60%. Diagnosticul final al pneumocistului se face atunci când chisturile sau trofozoizii sunt detectați în țesutul sau în lichidul alveolar [7, 9].
În prezent, examinarea pacienților cu suspiciune de dezvoltare a PP este efectuată conform schemei următoare: toți pacienții cu pneumonie sunt tratați empiric și numai cu un proces pulmonar sever se efectuează o biopsie pulmonară. În absența unui tratament specific adecvat pentru pneumocistoză, letalitatea ajunge la 100% la pacienții cu imunodeficiență și la 50% la sugarii prematuri. Prognozele rămân nefavorabile (în funcție de starea de fond) și fără corectarea statusului imunitar, la 15% dintre pacienți există recurențe de PP [4, 8].
La pacienții care nu au primit trimetoprim-sulfametoxazol (sau alte medicamente antibacteriene, modul chimioprofilaxia administrat la un risc crescut de a dezvolta pneumocistoza (tabelul. 2), există o mare probabilitate de apariție a pneumocistoza pe fondul dezvoltării infecției cu CMV care pot fi asociate cu blocarea macrofagelor alveolare și o scădere a funcției limfocitelor CD4.
Relativ pneumocistoza rata de detectie la pacientii cu sistemul imunitar compromis (care nu sunt incluși pacienții cu infecție HIV), trebuie remarcat faptul că, în absența unor măsuri preventive în timp util, în aproximativ 5-12% dintre pacienți au dislocat clinica pneumocistoza [13]. Utilizarea terapiei active antiretrovirale reduce semnificativ riscul de a dezvolta PP în SIDA. În cazul unei scăderi a CD4 <200/ммЁ в обязательном порядке назначается первичная профилактика P. jirovici -инфекции продолжительностью 4–6 мес [15].
Până în prezent, medicamentul de alegere pentru tratamentul PP este o combinație de trimetoprim și sulfametoxazol într-un raport de 1,5, administrat intravenos. Doza pentru adulți este de 20 mg trimetoprim (cu 100 mg sulfametoxazol) pe kg de greutate corporală pe zi. Medicamentele sunt administrate în trei porțiuni egale la intervale de 8 ore timp de 1-3 săptămâni (Tabelul 3). În cazul abandonului regimului standard de tratament, o alternativă ar putea fi numirea unei combinații de clindamicină și primaquin. Utilizarea acestei combinații pentru eficacitate este comparabilă cu utilizarea trimetoprimului în asociere cu sulfametoxazol. Ca un supliment la antibiotice in tratamentul de steroizi primul numit, în special în dezvoltarea de hipoxemie - pentru a preveni amplificarea insuficienta respiratorie pe fondul de la începutul terapiei antipnevmotsistnoy.
Ca exemplu de dezvoltare a PP la un pacient cu imunodeficiență severă cauzată de infecția cu HIV, prezentăm istoricul medical al pacientului. au ajuns la GVCG-le. NN Burdenko 05.11.04, plangandu-se de slăbiciune generală, febră, tuse, cantități minore de sputa mucoase, dispnee la efort, pierderea in greutate de 3-4 kg pe parcursul ultimelor 3 luni.
La interogatoriu pacientul a fost în măsură să stabilească faptul că boala se manifestă acut (15.10.04), pe fondul febrei stare generală de rău a apărut tuse neproductivă, dispnee la efort. El a fost tratat independent, a luat antipiretice, amoxicilină timp de 5 zile, cu un efect ușor pozitiv. În legătură cu deteriorarea (creșterea temperaturii repetate, crescând dispnee la efort mic) a apelat la clinică, în care atunci când este privit din verhnedolevaya stâng a fost diagnosticat cu pneumonie (confirmat radiologic). Având în vedere localizarea procesului inflamator, sa efectuat un diagnostic diferențial cu tuberculoză pulmonară. diagnostic de specialitate a tuberculozei nu a fost confirmată, iar modificările de pe radiografiile au fost considerate ca fiind manifestări ale fibrozei pulmonare difuze cu hipoventilație a lobului superior al plămânului stâng. De la anamneză, medicul a aflat, de asemenea, că în același an pacientul a repetat "curățarea corpului" prin rect.
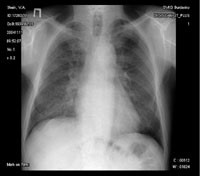
Figura 1. Privire de ansamblu a radiografiei toracice de la 11.11.04.
Figura 5. Acumulări ale Pneumocystis jiroveci în lumeni alveole (colorare prin metoda PAS). microfotografie
alveolocytes congestie capilară și disponibilitatea membranei hialine pe pereții alveolelor (figurile 4, 5): Conform materialului autopsie de la pacient prezența polysegmental bilaterale PP, au fost confirmate ARDS.
literatură
AF Shepelenko. Doctor de Medicină, profesor asociat
MB Mironov. Candidat la Științe Medicale
A. A. Popov
Spitalul Clinic Militar Principal. N. N. Burdenko,
MMA-le. IM Sechenov, GIUV MO RF, Moscova
aplicaţii
- Pneumocystis pneumonie la persoanele cu defecte severe de imunitate - Tabelul 1