O reacție chimică heterogenă poate avea loc numai dacă există o difuzie continuă moleculară sau convexă a substanțelor reactive la suprafața pe care are loc această reacție și o difuzie inversă continuă a produselor de reacție.
Viteza procesului în ansamblu va fi determinată de viteza celui mai lent stadiu. Dacă viteza de reacție de pe suprafața catalizatorului este mai mare decât rata de difuzie, atunci viteza de proces ca un întreg va fi determinată prin rata de difuzie. Kinetica macroscopică observată a reacției va respecta ecuațiile care pot fi obținute luând în considerare numai procesele de difuzie și, prin urmare, nu vor reflecta viteza reală a reacției chimice pe suprafața catalizatorului. În acest caz se spune că procesul se află în regiunea de difuzie. Procesul este cel mai adesea descris de ecuația de reacție de ordinul întâi, deoarece rata de difuzie este direct proporțională cu concentrația.
Dacă rata reacției chimice este mult mai mică decât rata de difuzie, atunci viteza procesului în ansamblu va fi determinată de viteza reacției chimice. În acest caz, procesul se află în regiunea cinetică și este descris prin ecuația cineticii reacției care are loc pe suprafața catalizatorului.
Dacă rata de difuzie și rata reacției chimice, considerate independent una de cealaltă, sunt comensurabile, atunci există o regiune de tranziție. Același proces, în funcție de condițiile de comportament, poate fi în diferite domenii. Presiunea de reacție a substanțelor, debitele, porozitatea catalizatorului și temperatura exercită o mare influență asupra naturii procesului chimic heterogen.
Atunci când temperatura este schimbată cu 10 ° C, rata de difuzie, după cum arată experiența, se modifică de aproximativ 1,2 ori, iar rata de reacție chimică este de 3-4 ori. Prin urmare, pe măsură ce temperatura este scăzută, rata reacției chimice scade mai repede decât rata de difuzie, iar la temperaturi scăzute procesul cel mai adesea curge în regiunea cinetică.
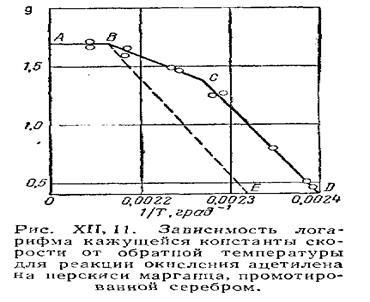
O formă tipică a dependenței logaritmului constantei de rată a unui proces eterogen față de mărimea temperaturii reciproce este prezentată în Fig. XII, 11. Secțiunea curbei AB care corespunde unei constante practic k (k nu depinde de temperatură) corespunde regiunii de difuzie a procesului. Secțiunea CD corespunde regiunii cinetice a procesului. Această zonă este, de obicei, caracterizată de o cantitate semnificativă de energie de activare. Dimensiunea aeronavei corespunde regiunii de tranziție. De obicei tranzițiile de la o zonă la alta nu sunt la fel de clare ca cele prezentate în figură și sunt descrise printr-o curbă netedă. Un astfel de curs al curbei este observat pentru catalizatorii porosi. Pe curbele care caracterizează suprafețele neporoase, regiunea de tranziție este practic absentă. Curba din punctul B schimba brusc direcția (BE), caracterizând regiunea cinetică a procesului.