Myoglobina și hemoglobina sunt proteine complexe, constând dintr-o parte proteică - globină și o non-proteină - hemă. Hemul constă dintr-un atom de fier și patru inele heterociclice de pirol conectate prin punți de metilen (Figura 8.5).
Este atomul de fier care este responsabil pentru formarea unei nuanțe diferite a culorii cărnii, deoarece este capabilă să oxideze cu ușurință și să dea un singur electron.
Ca urmare, se pot forma trei forme de mioglobină. În prezența oxigenului, mioglobina oxidează și formează oxiimoglobina (Mv02), care conferă cărnii o culoare roșie deschisă. Cu toate acestea, această conexiune nu este stabilă. Sub influența luminii, aerului, timpului de menținere, încălzirii, are loc o oxidare mai profundă. Fierul heme trece apoi de la bivalent la trivalent și Metmoglobin (MetMb) este format într-o culoare gri-gri. În interacțiunea mioglobinei cu hidrogen sulfurat în prezența oxigenului, se formează sulfomioglobina, un pigment de culoare verde.
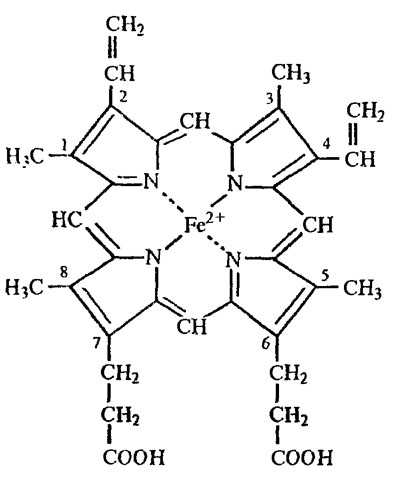
Fig. 8.5. Schema Heme
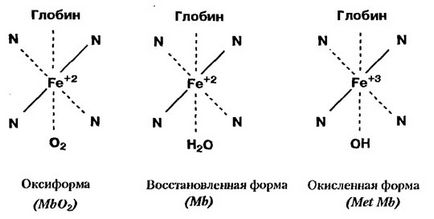
În carne proaspătă în prezența oxigenului, Mg este în mod constant transformat în MgO2 și MethylM în două etape:
I MWO2 <=> Mg + O2 - oxidare;
II Mw <=> MetMB - recuperare.
În prima etapă, se produce deoxigenarea MgO2 și transformarea lui în Mg. În
Atmosfera oxigenului, această reacție este reversibilă, dar dacă oxigenul este absorbit, atunci MB este acumulat. A doua etapă este oxidarea MB în MetMe. Rata de formare a MetMB asociate cu modificări ale presiunii parțiale de oxigen și formarea altor forme de mioglobina. Odată cu creșterea numărului de MTO%, care inhibă oxidarea Mg în MetMB (Fe2 + oxidare la Fe3 +) oxigen crește presiunea parțială, deoarece rezultă Mv02 semnificativ mai greu decât Mg este oxidat la MetMB. Dimpotrivă, când
scăzând presiunea parțială a oxigenului, Mv02 își dă oxigenul
iar Mg rezultat este ușor oxidat în MetMB. Rata maximă de formare MetMB este notată la o presiune parțială de oxigen de circa 5,69 kPa. Mai jos și deasupra acestei presiuni, rata de formare MetMB scade.
Formarea MgO2 în carne depinde de viteza și adâncimea de difuzie a oxigenului în țesutul muscular.
Dacă luăm în considerare carnea proaspătă tăiate au fost depozitate în aer, apoi la adâncimea suprafeței de 1-2 mm detectat strat roșu deschis cu oxigen-moglobina ar trebui să fie o zonă destul de largă de metmyoglobin l acolo unde există un oxigen optim pentru presiunea formarea sub predomină roșu închis mioglobina. În cazul depozitării pe termen lung ca rezultat al oxidării Mg în MetMB, carnea dobândește o nuanță brună. Rata de formare a MetMB scade odată cu scăderea temperaturii, deoarece la temperaturi joase, oxigenul difuzează în carne mai profund decât la temperaturi ridicate. Cu alte cuvinte, carnea stocată la o temperatură mai scăzută va deveni mai deschisă roșie. Rata formării MetMB depinde de mediul pH: crește cu scăderea pH-ului.
Procesul de reducere MetMe poate fi sporit prin adăugarea de agenți reducători, dintre care acidul ascorbic și cobaltul de sodiu de sodiu sunt utilizate pe scară largă.
Interconversia de mai sus a formelor de mioglobină este posibilă numai dacă se menține conformația nativă a părții sale proteice, globină.
Atunci când este încălzit la temperatura de denaturare a pigmenților din carne Mw capacitatea de a lega oxigenul este pierdut, carnea capătă o culoare gri-maroniu datorită formării și gemohromogenov hematins.
În practica tehnologică, proprietatea Me este folosită în mod activ pentru a conferi o culoare naturală produselor din carne, legând în mod activ oxidul de azot la un compus stabil care nu se degradează la temperaturi ridicate. În acest scop, se utilizează nitrit de sodiu. Formarea culorii produselor din carne sub acțiunea nitritului de sodiu este discutată în capitolul 13.
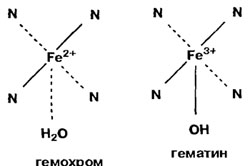
Fig. 8.6. Produse de distrugere a pigmenților