Definiția și formula propionat de sodiu
Propionatul de sodiu este un compus organic complex care aparține clasei de săruri ale acizilor carboxilici.
În condiții obișnuite, este un solid de structură cristalină (albastru monoclinic) în alb (Figura 1). Higroscopice. Se dizolvă bine în apă. Formează hidrații cristalini ai compoziției C2H5COONaxH2O.

Fig. 1. Propionat de sodiu. Aspect.
Formula chimică a propionatului de sodiu
Formula chimică a propionatului de sodiu poate fi înregistrată în diferite moduri: C2H5 COONa, CH3CH2COONa sau C3H5O2Na. Se arată că această moleculă conține trei atomi de carbon (Ar = 12 amu), cinci atomi de hidrogen (Ar = 1 amu), un atom de sodiu (Ar = 23 au .) și doi atomi de oxigen (Ar = 16 amu). Conform formulei chimice, este posibil să se calculeze greutatea moleculară a propionatului de sodiu:
Mr (C2H5 COONa) = 3x Ar (C) + 5xAr (H) + Ar (Na) + 2x Ar (O);
Mr (C2H5 COONa) = 3 × 12 + 5 × 1 + 23 + 2 × 16 = 36 + 5 + 23 + 32 = 96.
Formula grafică (structurală) a propionatului de sodiu
Formula structurală (grafică) este mai vizuală, reflectă modul în care atomii sunt legați împreună în interiorul moleculei de propionat de sodiu (figura 2).
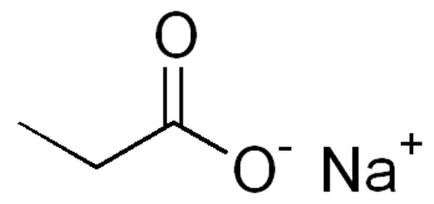
Fig. 2. Formula grafică a propionatului de sodiu.
Formula ionică
Propionatul de sodiu este un electrolit slab. Într-o soluție apoasă, sub influența unui curent electric, aceasta disociază parțial în ioni în conformitate cu următoarea ecuație:
Exemple de rezolvare a problemelor
Când a fost ars un amestec format din două volume de gaz necunoscut și un volum de jumătate de oxigen, s-a format un amestec dintr-un volum de azot și trei volume de vapori de apă. În toate cazurile, volumul de gaze se măsoară în aceleași condiții. Care este formula pentru un gaz necunoscut?
Deoarece arderea unui gaz necunoscut în oxigen produce azot molecular (N2) și apă (H2O), compoziția gazului include azot, hidrogen și, eventual, oxigen. Să desemnem numărul de atomi din fiecare dintre aceste elemente chimice ca "x", "y" și "z". Apoi formula pentru gazul necunoscut în formă generală va fi scrisă ca Nx Hy Oz.
Conform legii relațiilor de volum, volumele de gaze sunt proporționale cu cantitatea lor de materie și sunt egale cu coeficienții din ecuația de reacție. Având în vedere acest lucru, să scriem ecuația reacției de combustie a unui gaz necunoscut în oxigen într-o formă generală:
Conform legii conservării masei de substanțe, numărul atomilor fiecărui element de pe partea stângă și dreaptă a ecuației este același, prin urmare,
2x = 2; prin urmare, x = 1;
Prin urmare, formula pentru gazul necunoscut este NH3. Acesta este amoniacul.
Rezulta formula de hidrat cristalin de fosfat de zinc, daca se stie ca fractia de masa de sare din acesta este egala cu 84,2%.
Compoziția unității de formula a hidratului cristalin să includă n molecule de apă, adică formula de hidrat de cristal dat Zn3 (PO4) 2 × nH2O.
Calculăm greutatea moleculară a sării anhidre:
Domnul (Zn3 (PO4) 2) = 3 × 65 + 2 × 31 + 8 × 16 = 195 + 62 + 128 = 385.
Se știe că M = Mr, prin urmare M (Zn3 (PO4) 2) = 385 g / mol. Să găsim masa molară a hidratului cristalin:
Calculăm numărul de molecule de apă (masa molară a apei este de 18 g / mol):
Prin urmare, formula de hidrat de cristal de fosfat de zinc are forma Zn3 (PO4) 2 × 4H2O.