Hypermarket de cunoștințe >> Chimie >> Chimie 10 clasă >> Chimie: Tipuri de particule reactive și mecanisme de reacție în chimia organică.
Cea mai caracteristică legătură covalentă pentru compușii organici este formată prin suprapunerea orbitalilor atomici și formarea perechilor comune de electroni. Ca rezultat, se formează o orbită comună pentru cei doi atomi, pe care se află perechea totală de electroni. Atunci când legătura este întreruptă, soarta acestor electroni obișnuiți poate fi diferită.
Mecanismul de schimb al formării legăturii covalente. Legătura homolitice
O orbitală cu un electron nepereche aparținând unui atom se poate suprapune cu orbita unui alt atom, pe care există și un electron neparat. În acest caz, se formează o legătură covalentă în funcție de mecanismul de schimb:
H + + H-> N.H sau H-H
Mecanismul de schimb pentru formarea unei legături covalente se realizează dacă perechea electronică totală este formată din electronii neparticipați aparținând unor atomi diferiți.
Procesul opus formării unei legături covalente prin mecanismul de schimb este ruperea legăturii, în care un electron se lasă pentru fiecare atom. Drept rezultat, două particule neîncărcate sunt formate având electroni neparticipați:
Astfel de particule se numesc radicali liberi.
Radicalii liberi sunt atomi sau grupuri de atomi care au electroni neparticipati.
Mecanismul ruperii legăturii covalente, la care se formează radicalii liberi, se numește hemolitic sau homoliza (homo-identică, adică acest tip de rupere a legăturii duce la formarea de particule identice).
Reacțiile care se produc în cadrul acțiunii și cu participarea radicalilor liberi se numesc reacții cu radicali liberi.
În cursul chimiei anorganice ați întâlnit deja aceste procese. Aceste reacții sunt interacțiunea hidrogenului cu oxigenul, halogeni, reacția de combustie. Rețineți că reacțiile de acest tip se caracterizează prin viteză mare, eliberarea unei cantități mari de căldură. Cauzele acestor fenomene, precum și mecanismul reacțiilor înseși, caracteristice compușilor organici, vom lua în considerare oarecum mai târziu.
Mecanism donor-acceptor de formare a legăturii covalente. Eliberarea legăturilor heterolitice
O legătură covalentă poate fi de asemenea formată prin mecanismul donor-acceptor. Unul dintre orbitali atom (sau anion), pe care perechea de electroni cu un alt unshared se suprapune pe orbita goală a unui atom (sau un cation) având neumplut orbital, formând astfel o legătură covalentă, de exemplu:
Mecanismul donor-acceptor pentru formarea unei legături covalente se realizează dacă perechea electronică totală este formată dintr-o pereche de electroni neparticipată de un atom donator. Cel de-al doilea atom, acceptorul, trebuie să furnizeze o orbitală necompletată.
Metoda de scindare legătură covalentă, inversa formarea sa a unui mecanism donor-acceptor - heterolitice sau n-teroliz, conduce la formarea de particule încărcate pozitiv și negativ, deoarece în acest caz, ambii electroni din perechea de electroni totală să rămână la unul dintre atomii din celălalt atom este un orbital gol:
Deja cunoscuți din cursul chimiei anorganice, cazul heterolizei este disocierea electrolitică a acizilor:
Se poate ghici ușor că o particulă care are o pereche de electroni neparticipată R: -. adică un ion încărcat negativ, va fi atras de atomi încărcați pozitiv sau de atomi pe care există cel puțin o sarcină pozitivă parțială sau eficientă. Particulele cu perechi de electroni neparticipate se numesc agenți nucleofili (nucleul este nucleul, o parte încărcată pozitiv a atomului), adică "prieteni" ai nucleului, o sarcină pozitivă.
Nucleofilii (Nu) sunt anioni sau molecule care au o pereche de electroni împărțită în comun cu situsuri moleculare pe care se concentrează încărcarea efectivă pozitivă.
Exemple de nucleofile: anion de clor - (anion de clorură), OH - anion de hidroxid, anion CH30 - (anion de metoxid), anion CH3COO - (acetat).
Particulele care au o orbită goală, pe de altă parte, vor avea tendința să o umple și, prin urmare, vor fi atrase de secțiuni ale moleculelor pe care există o densitate electronică crescută, o sarcină negativă, o pereche de electroni neparticipată. Ele sunt electrofiluri, "prieteni" ai unui electron, o sarcină negativă sau particule cu o densitate de electron crescută.
Electrofilele sunt cationi sau molecule care au o orbită de electroni neîncărcată tinându-se să fie umplută cu electroni, deoarece aceasta duce la o configurație electronică mai avantajoasă a atomului.
Nu orice particulă cu o orbitală necompletată este un electrofil. De exemplu, cationii de metale alcaline au configurația de gaze inerte și nu au tendința de a achiziționa electroni, deoarece au o afinitate scăzută pentru electron. Din aceasta se poate concluziona că, în ciuda prezenței unui orbital neîncărcat în ele, astfel de particule nu vor fi electrofiluri.
Influența reciprocă a atomilor în moleculele de compuși organici
Una dintre cele mai importante propoziții din teoria structurii compușilor organici ai lui AM Butlerov este propunerea că proprietățile unui atom dintr-o moleculă sunt determinate nu numai prin natura sa, ci și prin împrejurimile sale cele mai apropiate.
Înainte de a începe să luăm în considerare mecanismele de reacție a compușilor organici, este necesar să se ia în considerare esența acestei influențe reciproce a atomilor și grupurilor de atomi în compușii organici.
Efectul inductiv. Să luăm în considerare distribuția densității electronice în moleculă de brommetan CH3Br. Legătura C-Br din moleculă de bromometan este polară. Ne amintim că polaritatea legăturii este determinată de electronegativitatea atomilor elementelor chimice, adică de capacitatea lor de a atrage electroni în sine în formarea unei legături chimice.
Electronegativitatea bromului este mai mare decât cea a cărbunelui și, ca rezultat, se formează o sarcină negativă Þ- pe atomul de brom și se formează o sarcină parțială Þ + pe atomul de carbon. Deplasarea electronilor de-a lungul legăturii C-Br poate fi demonstrată în două moduri - fie prin specificarea unei sarcini parțiale pe atomi, fie printr-o săgeată de-a lungul legăturii.
CH Þ + -Br Þ-CH3 -> Br
Deplasarea densității electronice a o-legăturii, care apare datorită diferenței dintre electronegativitățile atomului dat și atomului grupului de influență, se numește efectul inductiv (I).
Se obișnuiește să spunem că un atom cu o electronegativitate mai mare care atrage electroni are un efect negativ, acceptor, care este desemnat drept -I.
Ce poate duce la efectul I al bromului?
Atomul de halogen din molecula halogenoalcană (bromul în bromometan) este ușor înlocuit cu anionul hidroxilic sub acțiunea unei soluții apoase de alcalii.
Anionul hidroxilic este atras de atomul de carbon (atacă atomul de carbon), pe care se concentrează sarcina parțială pozitivă și înlocuiește bromul, mai precis, anionul de bromură.
În molecula 1-cloropropan, perechea de electroni din legătura C-Cl este deplasată spre atomul de clor din cauza unei electronegativități mai mari. În acest caz, atomul de carbon, care a primit o sarcină parțială pozitivă (g +), atrage electroni de la atomul de carbon legat de el. el, la rândul său, din următoarele:
Astfel, efectul inductiv este transmis de-a lungul lanțului, dar se distruge rapid: practic nu se observă după trei legături st.
Luați în considerare o altă reacție - adăugarea bromurii de hidrogen la etilena:
CH2 = CH2 + HBr -> CH3-CH2Br
În stadiul inițial al acestei reacții, cationul de hidrogen este atașat la o moleculă care conține o legătură multiplă:
CH2 = CH2 + H + -> CH2-CH3
Electronii legăturii n s-au deplasat la un atom de carbon, cel învecinat a fost o încărcătură pozitivă, o orbitală neîncărcată.
Stabilitatea unor astfel de particule este determinată de cât de bine este compensată sarcina pozitivă asupra atomului de carbon. Această compensare apare datorită deplasării densității electronice a a-legăturii către atomul de carbon încărcat pozitiv, adică efectul inductiv pozitiv (+1).
Un grup de atomi, în acest caz o grupare metil din care este extrasă densitatea electronică, are un efect donator, care este notat cu +1.
Efectul mezomeric. Există un alt mod de a influența alți atomi sau grupuri asupra altora - efectul mezomeric sau efectul conjugării.
Luați în considerare o moleculă de butadienă 1,3:
Se pare că legăturile duble din această moleculă nu sunt doar două legături duble! Deoarece sunt aproape unul de celălalt, există o suprapunere a n-legăturilor care fac parte din binarele vecine și se formează un nor de n-electron pentru toți cei patru atomi de carbon. În același timp, sistemul (moleculă) devine mai stabil. Acest fenomen se numește conjugare (în acest caz, n-n-conjugare).
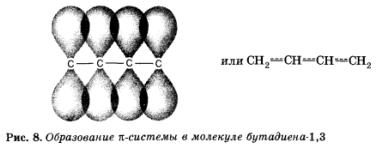
Suprapunerea suplimentară, conjugarea legăturilor n separate printr-o legătură o, conduce la "medierea" lor. Legătura centrală simplă capătă un caracter parțial "dublu", devine mai puternic și mai scurt, iar legăturile duble devin oarecum mai slabe și se prelungesc.
Un alt exemplu de conjugare poate fi efectul unei legături duble pe un atom care are o pereche de electroni neparticipată.
Astfel, de exemplu, în disocierea unui acid carboxilic, perechea de electroni neparticipată rămâne pe atomul de oxigen:
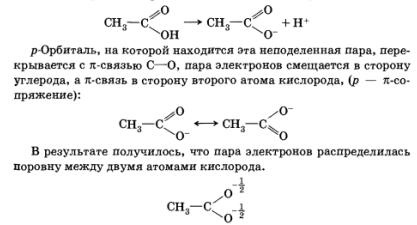
Aceasta conduce la o creștere a stabilității anionului format în timpul disocierii, la o creștere a rezistenței acidului.
Schimbarea densității electronilor în sistemele conjugate care implică n-legături sau perechi de electroni neparticipate se numește efectul mezomeric (M).
Principalele mecanisme de reacție
Am identificat trei tipuri principale de particule de reacție - radicali liberi, electrofile, nucleofile și trei mecanisme de reacție corespunzătoare:
• Radicali liberi;
• electrofilă;
• nucleofil.
Pe lângă clasificarea reacțiilor în funcție de tipul de particule care reacționează, se disting patru tipuri de reacții în chimia organică în conformitate cu principiul schimbării compoziției moleculelor: adăugarea, substituția, scindarea sau eliminarea și rearanjamentele. Deoarece adăugarea și substituția pot să apară sub acțiunea tuturor celor trei tipuri de particule reactive, pot fi identificate mai multe mecanisme de reacție de bază.
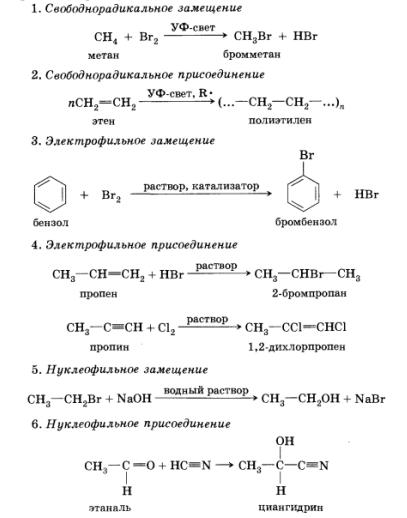
În plus, vom lua în considerare reacțiile de scindare sau eliminare care apar sub influența particulelor de bază nucleofile.
Se poate presupune că în această reacție molecula de hidrogen de brom este separată de molecula 2-brometan. În prezența alcaliilor se formează bromură de sodiu și apă.
1. Care sunt discontinuitățile homolitice și heterolitice ale legăturii covalente? Pentru ce mecanisme de formare a unei legături covalente sunt ele caracteristice?
2. Ce se numesc electrofile și nucleofile? Dați exemplele lor.
3. Care sunt diferențele dintre efectele mezomerice și inductive? Cum aceste fenomene ilustrează poziția teoriei structurii compușilor organici ai AM Butlerov despre influența reciprocă a atomilor în moleculele de substanțe organice?
4. În lumina noțiunilor de efecte inductive și mezomerice, luați în considerare influența reciprocă a atomilor în molecule:
Confirmați-vă concluziile cu exemple de ecuații de reacție chimică.
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.