Probleme care utilizează legea acțiunii în masă
De câte ori va trece viteza unei reacții chimice directe într-o schimbare de sistem omogenă: 2NO + Br2 = 2NOBr2
când: a) concentrația de NO este dublată
b) o scădere triplă a Br2
Deoarece se spune că sistemul este omogen, toate substanțele sunt în fază gazoasă, iar concentrațiile lor intră în formula legii acțiunii în masă. Se scrie expresia pentru această reacție: 1 = k [NO] 2 [Br2]
a) Prin creșterea concentrației de NO este de trei ori lege formula de acțiune în masă ar fi după cum urmează: 2 = k [2NO] 2 [Br2] = 4k [NO] 2 [Br2] (2 efectuate sub concentrație placă și ridicată în ei pătrat). Astfel 2 / 1 = 4k [NO] 2 [Br2] / k [NO] 2 [Br2] = 4. Prin urmare, rata reacției directe va crește de 4 ori.
b) Când concentrația de Br2 este redusă cu un factor de trei, formula pentru legea acțiunii în masă va fi următoarea: 2 = k [NO] 2 [
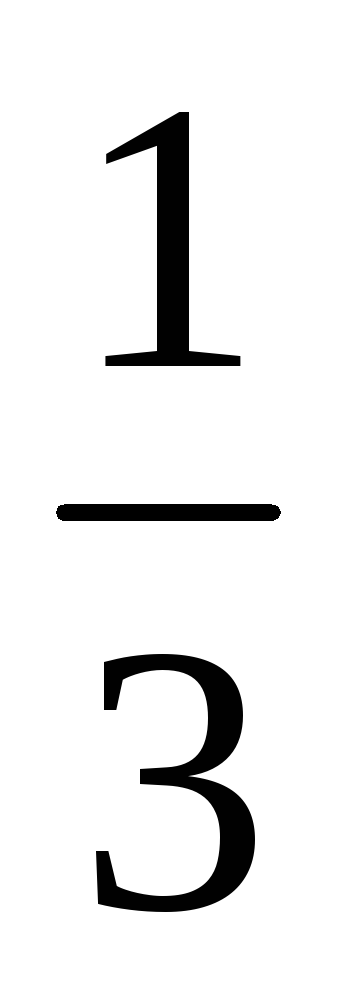
De câte ori se va schimba viteza reacției chimice directe în sistem: 3A (r) + B (r) = 2C (r)
pentru: a) creșterea volumului de cinci ori
b) creșterea presiunii de două ori
Întrucât toate substanțele sunt în stare gazoasă, concentrațiile lor intră în formula legii de acțiune a maselor.
Se scrie expresia acestei reacții: 1 = k [A] 3 [B]
a) O creștere a volumului (sau cu o presiune în scădere) în al n-lea număr de ori concentrația substanțelor gazoase reacționează redus în aceeași cantitate de timp, t. e. cu volum de cinci ori concentrația de A și B sunt reduse în cinci ori. Prin urmare, 2 = k [
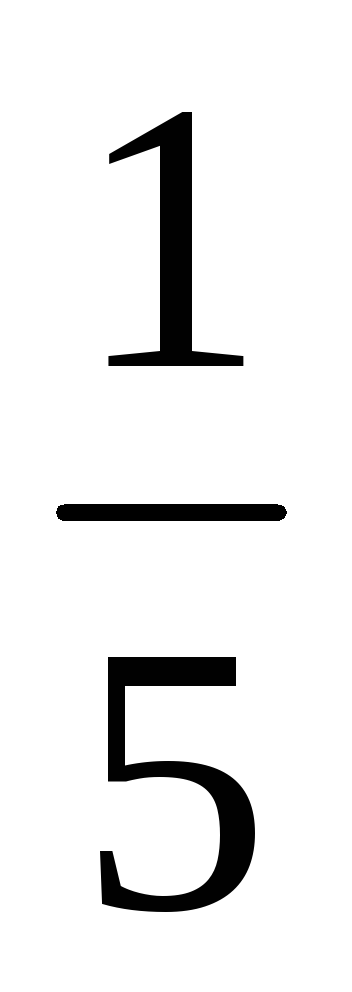
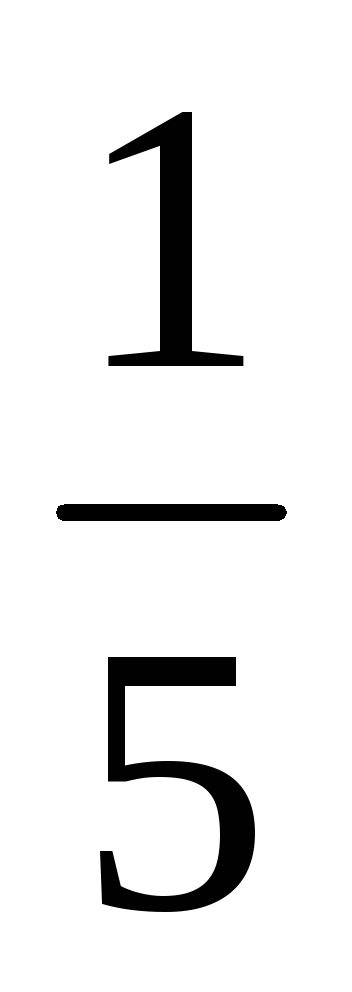
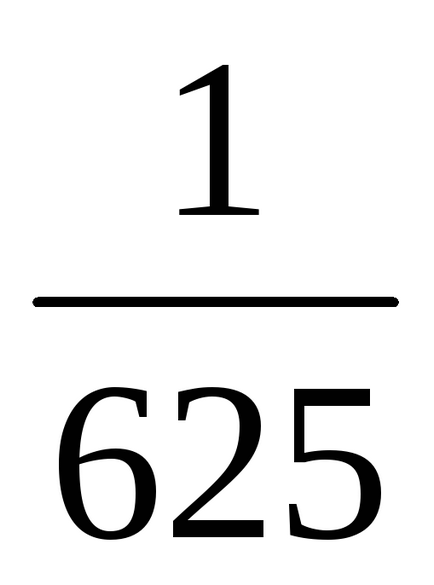
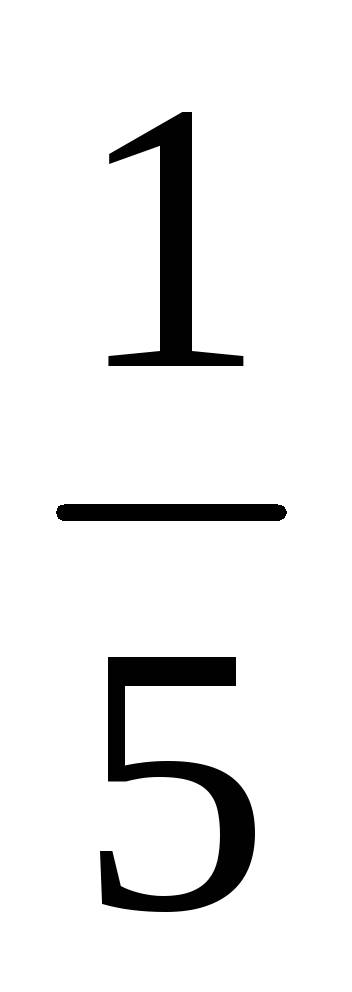
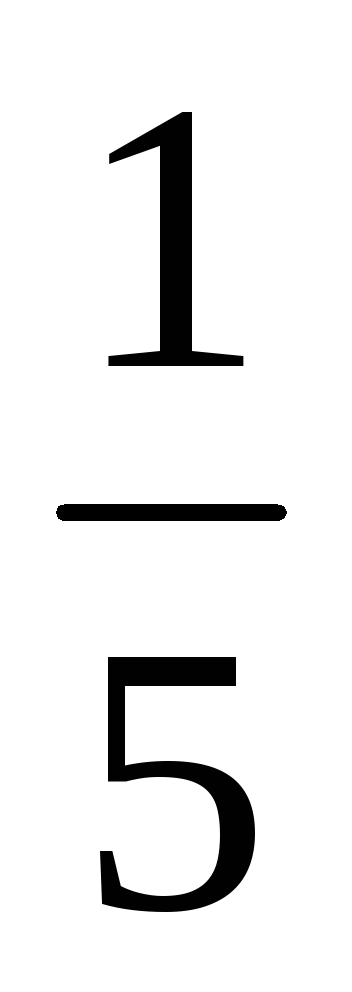
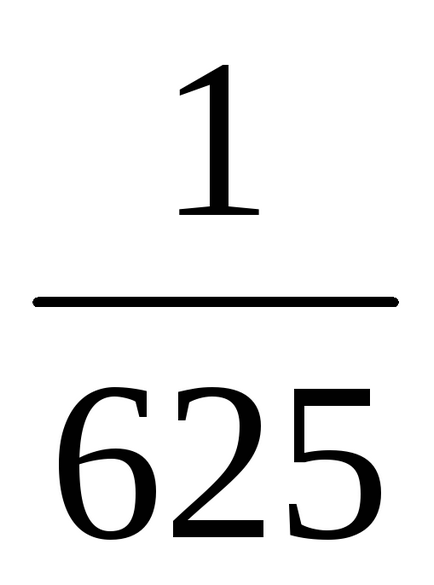
b) Atunci când presiunea este în creștere (sau descreștere volum) în n-lea număr de ori concentrația substanțelor gazoase reacționează sunt crescute în aceeași cantitate de timp, t. e. atunci când presiunea crește de două ori concentrația de A și B este dublat. De aici 2 = k [2A] 3 [2B] = 16k [A] 3 [B]. Astfel 2 / 1 = = 16k [A] 3 [B] / k [A] 3 [B] = 16. În consecință, rata reacției directe va crește de 16 ori.
Cum va scădea volumul cu patru ori viteza următoarelor reacții:
a) Astfel, în acest sistem, una dintre substanțe (C) este în stare cristalină, atunci concentrarea ei nu va intra în formula legii acțiunii în masă. Prin urmare, 1 = k [O2]. Cu o scădere a volumului cu un factor de patru, concentrația de O2 crește de patru ori și 2 = k [4O2] = 4 k [O2]. Prin urmare, 2 / 1 = = 4k [O2] ./k [O2] = 4 și viteza reacției directe va crește de 4 ori.
b) Întrucât există o singură substanță între substanțele inițiale și în stare cristalină, modificarea volumului nu va afecta viteza reacției directe și nu se va schimba. __________________________________________________________________________
SFAT: atenție la starea în care substanța este în reacție și amintiți-vă că concentrațiile de substanțe în starea cristalină nu sunt luate în considerare.