Strict vorbind, locația relativă a subsolurilor nu se datorează atât energiei mai mari, cât și celei mai mici, ca și cerinței unui minim de energie totală a atomului.
Distribuția electronilor de-a lungul orbitalilor atomici are loc, începând cu orbitalul, care are cea mai mică energie (principiul energiei minime), adică electronul se află pe cel mai apropiat orbital la nucleu. Aceasta înseamnă că mai întâi subsolurile sunt umplute cu electroni, pentru care suma valorilor numerelor cuantice (n + 1) a fost minimă. Deci, energia electronilor de pe substraturile 4s este mai mică decât energia electronului localizat pe podeaua 3d. În consecință, umplerea subsolurilor cu electroni are loc în următoarea ordine: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d
4F <6p <7s <6d
Pe baza acestei cerințe, se obține un minim de energie pentru cei mai mulți atomi atunci când subsilele lor sunt umplută în secvența prezentată mai sus. Există însă și excepții, pe care le puteți găsi în tabelele "Configurații electronice ale elementelor", dar rareori aceste excepții trebuie luate în considerare atunci când se iau în considerare proprietățile chimice ale elementelor.
atom de crom nu are nici o configurație de electroni 3d 2 4s 4. 1 4s 3d 5. Acesta este un exemplu al modului în care condițiile de stabilizare cu electroni paralele se învârte mică diferență prevalează față stările energetice ale subnivele 3d si 4s (regula Hund lui), este energetic favorabil pentru statele d-d subnivel este 5 și d 10. Diagrama energetică a subnivele de valență ale atomilor de crom și cupru sunt prezentate în ris.2.1.1.
O tranziție similară a unui electron de la s-subsub la sub-subsol apare și în 8 elemente: Cu, Nb, Mo, Ru, Ag, Pt, Au. La atomul Pd, există o tranziție de doi s-electroni la d-subsub: Pd 5s 0 4d 10.
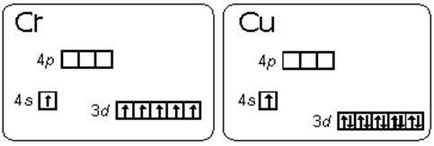
Ris.2.1.1. Diagrame energetice ale substraturilor de valență ale atomilor de crom și cupru
Reguli pentru umplerea cojilor electronice:
1. Mai întâi aflăm câți electroni conțin atomul elementului de interes. Pentru aceasta este suficient să se cunoască sarcina nucleului său, care este întotdeauna egală cu numărul ordinal al elementului din tabelul periodic al lui DI Mendeleev. Numărul ordinal (numărul de protoni din nucleu) este exact egal cu numărul de electroni din întregul atom.
2. Umpleți în mod succesiv orbitalii, începând cu orbitalii 1s, cu electronii disponibili, ținând seama de principiul energiei minime. În acest caz, este imposibil să avem mai mult de doi electroni cu rotiri îndreptate opus pe fiecare orbital (regula lui Pauli).
3. Notați formula electronică a elementului.
Un atom este un microsistem complex, dinamic stabil, de particule interacționate: protoni p +. neutronii n 0 și electronii e -.
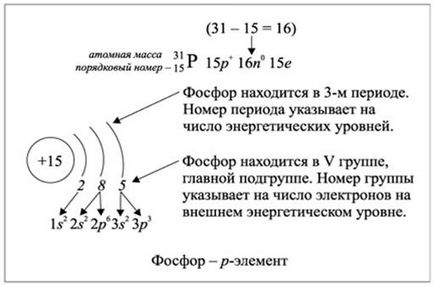
Ris.2.1.2. Umplerea nivelurilor de energie cu electronii unui element fosfor
Structura electronică a atomului de hidrogen (z = 1) poate fi reprezentată după cum urmează:
+1 H 1s 1. n = 1 ↑, unde o celulă cuantică (orbitală atomică) este desemnată drept linie sau pătrat, iar electronii - sub formă de săgeți.
Fiecare atom al elementului chimic următor în sistemul periodic este un atom multi-electron.
Atât atomul de litiu, cât și atomul de hidrogen și heliu, au structura electronică a s-elementului, deoarece ultimul electron al atomului de litiu "stă" pe s-subsol:
Primul electron în stare p apare în atomul de bor:
Este mai ușor să arătați o formulă electronică pe un exemplu concret. Să presupunem că trebuie să găsim formula electronică a unui element cu numărul de serie 7. Trebuie să existe 7 electroni în atomul unui astfel de element. Completați orbita cu șapte electroni, începând cu orbitele 1s inferioare.
Deci, doi electroni vor fi localizați pe 1s-orbitale, 2 mai multe electroni - pe 2s-orbitale, iar restul 3 electroni pot fi plasați pe trei orbite 2p.
Formula electronică a elementului cu numărul de serie 7 (acest element este azot având simbolul "N") arată astfel:
Luați în considerare acțiunea regulii Gund asupra exemplului atomului de azot: N 1s 2 2s 2 2p 3. La cel de-al doilea nivel electronic, există trei p-orbitale identice: 2px, 2py, 2pz. Electronii le vor popula astfel încât fiecare dintre aceste orbite p va avea câte un electron. Acest lucru se explică prin faptul că în celulele vecine electronii se repetă reciproc mai puțin, ca particule încărcate de același nume. Formula electronică a azotului obținută de noi prezintă informații foarte importante: nivelul de electroni al azotului (extern) al atomului de azot este umplut cu electroni, nu complet (există 2 + 3 = 5 electroni de valență) și trei electroni nu sunt plini.
Nivelul exterior al atomului este nivelul, care este cel mai îndepărtat de nucleu, pe care există electroni de valență. Aceasta coajă vine în contact atunci când se ciocnește cu nivelele exterioare ale altor atomi în reacțiile chimice. Atunci când interacționează cu alți atomi, azotul poate să ia trei electroni suplimentari la nivelul său extern. În acel moment, atomul de azot va primi o valoare completă, adică nivelul maxim electronic extern umplut, pe care vor fi localizați 8 electroni.
Nivelul complet este energetic mai favorabil decât cel neterminat, prin urmare atomul de azot ar trebui să reacționeze cu ușurință cu orice alt atom capabil să dea 3 electroni suplimentari pentru a-și completa nivelul extern.
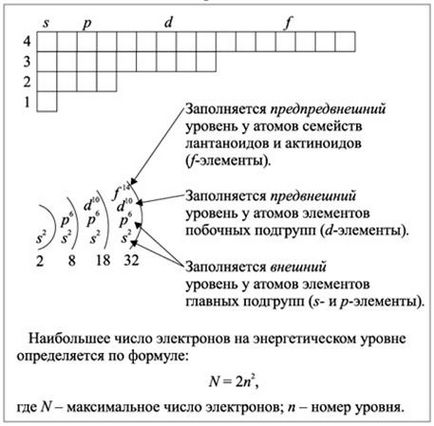
Ris.2.1.3. Umplerea nivelurilor de energie pentru elementele s, p, d și f prin electroni