Magneziul este al 12-lea element al sistemului periodic. Metal. Situată în a treia perioadă, subgrupul II al grupului A.
Numărul secvenței este 12. Încărcarea kernelului este de +12. Greutatea atomică este de 24132 amu.
Structura electronică a atomului de magneziu
Magneziul se află în a treia perioadă, deci are trei cochilii, dintre care unul este exterior, conținând electroni de valență. Atomul de magneziu are un miez încărcat pozitiv (+12), în care sunt 12 protoni și 12 neutroni (diferența dintre greutatea atomică și numărul atomic). 12 electroni se deplasează de-a lungul orbitelor din jurul nucleului.
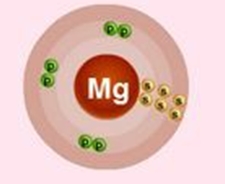
Fig. 1. Reprezentarea schematică a structurii atomului de magneziu.
Configurația electronică a atomului de magneziu poate fi scrisă în două moduri:
1s 2s 2p 2s 6s 2s
Magneziul aparține familiei elementelor s. Schema energetică a atomului de magneziu (numai electronii de valență sunt descriși pe el) are forma:
Ca rezultat al interacțiunii chimice, magneziul își pierde electronii de valență, adică este donatorul lor și se transformă într-un ion încărcat pozitiv (Mg2 +):
Mg0-2e → Mg2 +;
În compuși, magneziul prezintă o stare de oxidare de +2.
Exemple de rezolvare a problemelor
Elementul chimic al subgrupului principal corespunde oxidului superior al compoziției RO3. Care este configurația electronică a nivelului energetic extern al atomului acestui element?
Este necesar să se determine la ce grupă a sistemului periodic se aplică elementul care formează oxidul superior al compoziției RO3. Deoarece în oxizi oxigenul prezintă o valență constantă egală cu II, cea mai mare valență a elementului din oxidul R VI O II 3 este VI.
Rezultă că acesta este un element al grupului VIA, în atomii lui de atomi de valență. Această cerință corespunde unui element cu formula electronică ns 2 np 4.