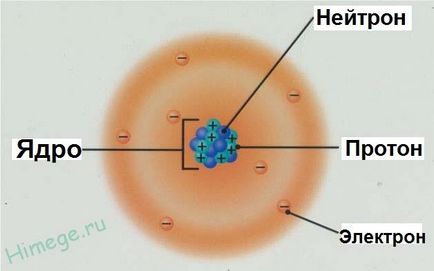
Modelul atomului de azot
Toate corpurile care ne înconjoară, în ciuda diversității lor, constau din particulele cele mai mici - atomi care, la rândul lor, constau din particule chiar mai mici - protoni, neutroni și electroni. Acest lucru a devenit cunoscut relativ recent, atomul a fost mult timp considerat o particulă indivizibilă, adică cea mai simplă (a se vedea istoria dezvoltării ideilor despre atom).
În inima teoriei moderne a structurii atomului sunt următoarele puncte principale:
- Atomul constă dintr-un nucleu și o coajă de electroni
- Cochila de electroni este setul de electroni care se deplasează în jurul nucleului
- nucleele atomice sunt încărcate pozitiv, ele sunt compuse din protoni și neutroni p n (împreună sunt numite nucleoni) .Zaryad nucleu este egal cu suma protonilor (marcate cu roșu pe figură).
- Atomul ca întreg este neutru din punct de vedere electric, numărul de electroni e este egal cu numărul de protoni p +. este egal cu numărul ordinal al elementului din tabelul periodic. Este sarcina nucleară care este principala caracteristică a atomului și determină poziția sa în tabelul periodic. Un element chimic este un set de atomi cu aceeași încărcătură nucleară.
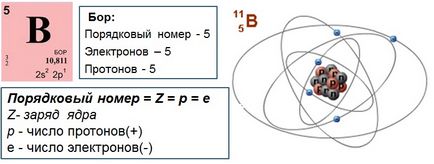
- Dacă un atom atașează sau emite electroni (purtând o sarcină negativă), atunci electroneutralitatea sa este încălcată, se transformă într-un ion încărcat negativ sau pozitiv.
În formarea unui ion încărcat pozitiv scade numărul de electroni (cantitatea de sarcină a ionului) și formarea unui ion încărcat negativ crește numărul de electroni (cantitatea de sarcină a ionului).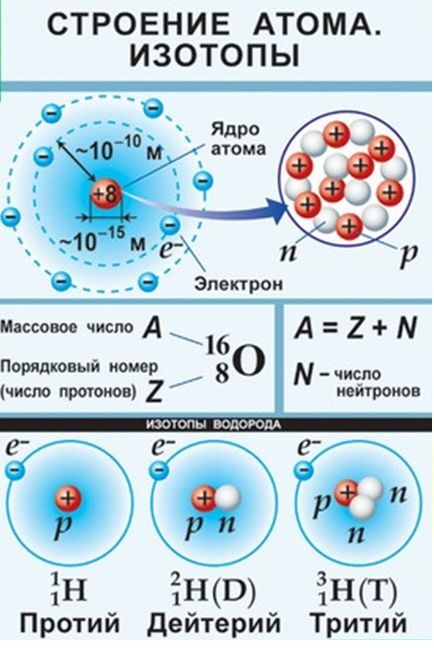
E0 + ne - = ln-
În atomi există mici nuclee grele, care conțin protoni și neutroni și în care aproape toată masa atomului este concentrată. Cea mai mare parte a atomului este plină de electroni și reprezintă un spațiu aproape gol.
În natură, există atomi de un singur element, adică având aceeași acuzație a nucleului, dar numere de masă diferite - izotopi (de la ισος greaca veche -. «Egal“, «același» și τόπος - locul «“, ocupă același "Place" în tabelul periodic). Ei au același număr de protoni, dar numere diferite de neutroni. Y element de hidrogen există trei izotopi: Protium - un număr de masă de 1, Deuteriu - cu un număr de masă 2 (D2O - apa grea) și tritiu radioactiv cu un număr de masă 3.
Tabelul periodic prezintă masa atomică relativă, media aritmetică a masei de izotopi, ținând cont de conținutul lor de% în crusta pământului.
Numărul de neutroni nu este indicat în tabel, astfel încât pentru a calcula numărul de neutroni, este necesar să se scadă numărul din ordine (numărul de protoni) din masa atomului (indicată în sarcină).
În reacțiile chimice, compoziția nucleelor atomice nu se modifică (cu excepția reacțiilor nucleare - nu sunt luate în considerare în acest curs, domeniul fizicii), numai compoziția coajălui de electroni (numărul de electroni) poate varia. Prin urmare, este important pentru noi să știm cum sunt aranjați electronii din atom, adică structura coajelor de electroni ale atomilor.
Electronii sunt localizați în spațiul tridimensional în jurul nucleului atomului. În interiorul acestui spațiu există zone în care se pot localiza electroni. Aceste zone sunt numite orbite. Fiecare orbital se caracterizează prin dimensiunea, forma și orientarea sa în interiorul atomului și fiecare are o denumire alfanumerică.
Deși există un număr mare de orbite în atom, în condiții obișnuite doar o parte relativ mică este ocupată de electroni. Mai jos este o listă a denumirilor general acceptate ale celor opt orbite care au fost primii (adică cei mai apropiați de nucleu). Cifra (număr) caracterizează mărimea sau diametrul mediu al orbitalilor, iar litera - forma orbitalilor. s-reprezentare-Orbital dorința de a crea o sferă al cărei centru coincide cu atomul central (miez) și trei orbitali p semene volumetric opt axe sunt perpendiculare una pe cealaltă. Astfel, 1s-orbitalul este de tip sferic și cel mai mic; 2s-orbitalul este de asemenea sferic, dar cu o dimensiune mai mare; Orbalele 2p sunt sub forma de optari și în mărime sunt comparabile cu orbitalul 2s. d-Orbital au o formă mai complexă.
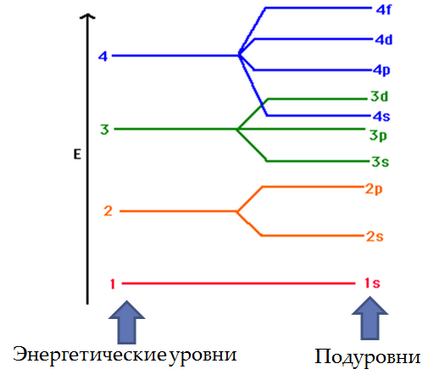

Orbital sunt grupate în funcție de mărimea lor și aceste grupuri sunt numite straturi sau cochilii sau niveluri de energie. În prima coajă de electroni există o singură orbitală - 1s. Pe a doua coajă există deja patru, iar pe a treia - nouă. Fiecare orbital poate fi liber (gol) sau ocupat de unul sau doi electroni. Rețineți că în fiecare coajă (cu excepția primei) există trei p-orbitale și cinci d-orbitale (în toate coajările cu excepția primelor două). Deoarece fiecare orbită, pot exista 2 bandă de electroni p-orbitali poate ocupa mai mult de 6 electroni, iar grupa d-orbitaley - 10 electroni.
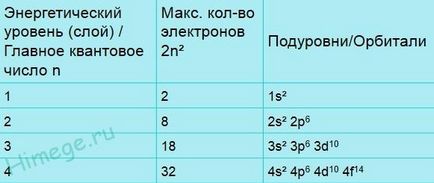
Configurația electronică a atomilor de oxigen și sulf este dată mai jos.
