LUCRĂRI DE LABORATOR 11
Complexul este numit compus, la nodurile latticelor cristaline, ale căror ioni complexi sunt capabili de existență independentă în soluții. De exemplu, K2 [HgI4], [Cu (NH3) 4] Cl2.
Astfel de substanțe complexe se formează ca rezultat al combinării moleculelor neutre fără apariția de noi perechi de electroni:
Conform teoriei coordonării lui Werner, un atom dintr-un ion complex (de obicei încărcat pozitiv) servește ca atom central (agent de complexare). În jurul acestuia este coordonat un anumit număr de anioni sau molecule neutre - liganzi, care împreună cu atomul central formează sfera interioară a unui compus complex sau a unui ion complex. În formule, ionul complex (sfera de coordonare) este separat de paranteze pătrate. Ionii rămași formează sfera exterioară a compusului complex. Astfel, în K2 [HgI4], Hg2 + este un agent de complexare; I - liganzi; ioni K + - sfera exterioară.
Ionul complex poate conține simultan liganzi heterogeni. În complexul [Co (NH3) 3 (H20) 2CI] 2+, liganzii sunt molecule NH3. H2O și ion.
Numărul de liganzi care înconjoară agentul de complexare se numește numărul de coordonare (c.ch) al acestui agent de complexare, de exemplu:
Adesea, dar nu întotdeauna, numărul de coordonare este egal cu dublul încărcării agentului de complexare. Numărul de coordonare pentru mulți agenți de complexare nu este constant.
Încărcarea unui ion complex este egală cu suma algebrică a sarcinilor agentului de complexare și a liganzilor. Astfel, ionul [Fe (CN) 6] x include un agent de complexare Fe2 + și liganzi - ioni CN; prin urmare, x = + 2 + 6 (-1) = -4. Ionul [Co (NH3) 4Cl2] x conține agentul de complexare Co 3+ și liganzii sunt molecule de NH3 (nu au încărcătură) și ioni Cl. prin urmare, x = + 3 + 4 (0) + 2 (-1) = +1.
Compușii cei mai complexi sunt electroliții și se disociază în soluții în ioni complexi și ioni ai sferei exterioare (disociere primară):
Ionii complexi în soluție într-o oarecare măsură se disociază reversibil într-un agent de complexare și liganzi (disociere secundară):
Constantele de echilibru ale proceselor de disociere secundara sunt numite constantele de instabilitate KH ale ionului complex:
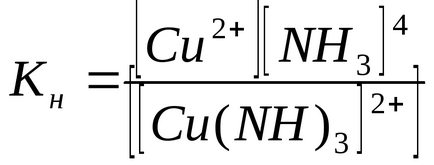
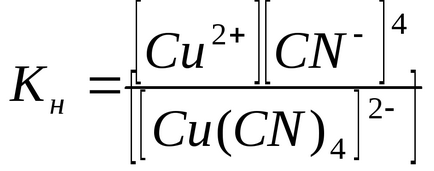
Valoarea KH determină puterea ionului complex: cu cât acesta este mai mic, cu atât ionul complex este mai stabil. Din datele prezentate, se poate observa că ionul complex [Cu (CN) 4] 2 este considerabil mai puternic decât ionul [Cu (NH3) 4] 2+.
Consolida disocierea ionului complex și poate chiar distruge prin încălzire, diluare, adăugarea de substanțe care una dintre componentele formei de ioni complexe molecule și ioni chiar mai puțin disociați. De exemplu, ionul complex [Ag (NH3) 2] + (KH = 6,8 × 10-8) poate fi distrus prin adăugarea de ioni de Ni 2+. deoarece ionul Ni 2+ formează un ion complex mai puternic [Ni (NH3) 6] 2+ (KH = 2,0 ∙ 10-9) cu molecule de amoniac:
Adăugarea unui acid puternic la ionii complexi care conțin molecule NH3. duce la distrugerea lor. Ioni de hidrogen ai acidului cu molecule de NH3 formează ioni de NH4 + mai puternici:
Compușii complexi, care în soluții apoase se descompun aproape complet în ioni și molecule simple, se numesc săruri duble. Astfel, sarea dublă a KFe (SO4) 2 disociază conform ecuației:
și toți ionii formați în soluție pot fi detectați prin reacții adecvate. Formulele de săruri duble sunt scrise fără paranteze pătrate: NaAl (SO4) 2. KMgCl3.
Scopul acestei lucrări este familiarizarea cu principalele modalități de obținere a compușilor chimici complexi și a unor proprietăți chimice.
Echipamente și materiale: un trepied cu tuburi de testare.
Reactivi: pulbere de magneziu, hârtie de turnesol, hârtie indicator universal, hârtie de filtru, soluția: sulfat de aluminiu, hidroxid de sodiu (2,1 N cu conc ..), sulfat de cupru, hidroxid de amoniu conc. kvastsovNH4Fe fier-amoniu (SO4) 2, ammoniyaNH4NCS tiocianat, clorură de bariu, clorură de sodiu, azotat de argint, acid azotic (2,1 n.), sulfatul de nichel.
Experimentul 1. Prepararea compușilor cu un anion complex (compus complex de aluminiu)
Într-un tub cu 5 picături dintr-o soluție de Al2 (SO4) 3, se adaugă prin picurare o soluție de hidroxid de sodiu (NaOH). Precipitatul rezultat de Al (OH) 3 este dizolvat, adăugând un exces de alcaline la precipitat. Formulează ecuațiile moleculare și ionice ale reacțiilor de formare a hidroxidului de aluminiu și a tetrahidroxaluminatului de sodiu. Scrieți o expresie pentru constanta de instabilitate a unui ion complex.
Experimentul 2. Prepararea compușilor cu un cation complex (amminat de cupru)
La o soluție concentrată de sulfat de cupru CuSO4 (5 picături suficient) surge soluție concentrată de amoniac mai întâi, pentru a forma un precipitat albastru de gidroksosulfata cupru, apoi până se dizolvă (formarea soluție albastră). Scrieți ecuațiile moleculare și ionice ale reacțiilor corespunzătoare transformărilor:
Scrieți o expresie pentru constanta de instabilitate a unui ion complex.
Experimentul 3. Diferența de săruri duble din compușii complexi
Se toarnă 5 picături de soluție de aluminiu-amoniu NH4 Fe (SO4) 2 în trei tuburi. În unul dintre ele se adaugă câteva picături de tiocianat de amoniu NH4 NCS; în cealaltă, adăugați o mică soluție de BaCl2; în al treilea se adaugă o soluție concentrată de NaOH soda caustică și ușor căldură. Observați apariția culorii roșii în primul tub, format un precipitat alb, în al doilea și recuperarea amoniacului din al treilea miros caracteristic (amoniac detectată prin hârtie decolorare indicator umed, badged tuburilor de deschidere).
Scrieți ecuațiile ionice ale reacțiilor. Pentru a trage o concluzie, ce sare sunt alum (dublu sau complex). Scrieți ecuația de disociere electrolitică a alumului de fier-amoniu.
2. Tubul conținând 5 picături de hexacianoferat (III) de potasiu K3 [Fe (CN) 6] a adăugat câteva picături de tiocianat de amoniu NH4 NCS. De ce nu apare culoarea roșie? Formulați ecuația disocierii electrolitice a hexacianoferatului (III) de potasiu.
Experiența 4. Distrugerea unui ion complex. Formarea unui ion complex nou, mai stabil
Pentru a obține o soluție de argint [Ag (NH3) 2] CI diamină, se toarnă aproximativ 1 cm3 soluție de AgNO3 într-un tub de testare cu soluție de NaCl (1-2 cm3). Precipitatul de clorură de argint precipitat este dizolvat într-un exces de soluție de amoniac.
Soluția rezultată a sării [Ag (NH3) 2] Cl este împărțită în două eprubete. În una dintre ele se adaugă o soluție de acid azotic. Explicați formarea de sedimente, scrieți ecuații moleculare și ionice pentru reacțiile de formare și distrugere a unui ion complex.
Se adaugă o soluție de NiSO4 într-un alt tub. din nou, un precipitat alb de AgCl este precipitat. Formulează în formă moleculară și ionică ecuația de reacție, având în vedere că, în plus față de precipitatul de clorură de argint, se formează sulfat de hexaamminicel (II).