Idei generale despre fiziologia țesuturilor excitabile
Reacția biologică este răspunsul celulelor, țesuturilor și organelor ca răspuns la stimul (stimul).
Iritabilitatea este proprietatea tuturor țesuturilor vii de a-și schimba starea internă atunci când condițiile externe se schimbă.
Tipuri de țesuturi în funcție de răspunsul la stimuli externi:
I Excitable - au proprietatea excitabilității, adică capacitatea de a fi nervos, muscular, glandular.
II Neconectat - schimbați starea lor, dar nu generați un proces de excitație ca răspuns la stimulul aplicat.
Excitabilitatea - capacitatea unui țesut de a intra într-o stare excitată.
Excitația - starea activă a țesuturilor ca răspuns la stimul, aceasta este un răspuns biologic complex, manifestat într-un set de modificări funcționale fizice, fizico-chimice și, capacitatea de a răspândi peste material.
Excitarea include componente nespecifice și specifice.
Non-specifice:
schimbarea reacțiilor chimice, formarea căldurii, modificări fizico-chimice,
producția de biopotențiali, modificări structurale în membrana celulară.
specifice:
țesutul muscular răspunde contracției musculare, țesutului nervos - generarea impulsului nervos și conducerii acestuia, formarea țesutului glandular și secreția secrețiilor.
Excitarea poate fi locală și dinamică (propagând).
biopotențialelor
Luigi Galvani în 1791 într-un experiment a arătat că țesuturile vii conțin „electricitate animală“, adversarii sale științifice, Volta fizician - este electricitate din metale diferite, el a creat prima sursă de curent constant, care se numește o celulă galvanică.
Tipuri de biopotențiali:
1. Biopotențial de repaus (membrană) - MPP.
2. Biopotențial de acțiune (excitație) - PD.
- Biopotențialul de repaus este diferența de potențial dintre suprafața exterioară și cea interioară a membranei celulare în repaus. Suprafața exterioară a membranei celulare are o încărcătură pozitivă, în timp ce suprafața interioară este negativă.
Biopotențialul de repaus este înregistrat prin metoda intracelulară - cu ajutorul microelectrodelor, dintre care una este introdusă în celulă (figura 1).
Figura 1. Reprezentarea schematică a metodei de înregistrare a biopotențialiilor.
În cadrul experimentului, biopotențialul de odihnă poate fi înregistrat între locul țesutului deteriorat și cel nedeteriorat. Zona afectată este un model al suprafeței interioare a membranei celulare.
Cu devierea intracelulară, reîncărcarea cu membrană este înregistrată sub un singur electrod (PD cu o singură fază), cu captare extracelulară, potențialul de acțiune trece prin doi electrozi (se înregistrează un PD cu două faze).
- Acțiunea biopotențială - modificări pe termen scurt în amplitudine în MPP, care apar în timpul excitației. PD este înregistrat în țesuturi iritabile, în care apare un val de excitație (figura 2). PD este măsurată utilizând răpirea intracelulară și plumbul extracelular.
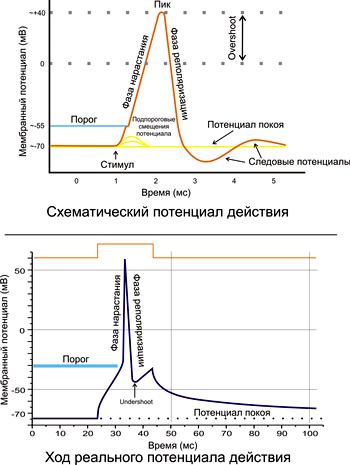
Figura 2. Potențialul acțiunii, fazele sale principale.
O teorie moderna, demonstrata experimental, despre membrana ionica a aparitiei biopotentialelor (Hodgkin, Huxley, Katz).
- Procesele electrice apar pe membrana plasmatică a celulei, care constă dintr-un strat lipidic bimolecular (nucleul membranei) și proteine care îndeplinesc diferite funcții în membrană: receptori, canale de formare enzimatică și pompe în el (Figura 3).
Canalul de membrană poate fi nespecific, este în mod constant deschis, nu are mecanism de poartă, influențele electrice nu își schimbă starea. Ei numesc canalul "scurgeri". Canalele specifice (selective) au un mecanism de poartă, astfel încât acestea pot fi fie în stare deschisă, fie în stare închisă, în funcție de efectele electrice pe membrană și numai un anumit ion este trecut. Acest canal este format din trei părți: un porii de apă - căptușit în interior cu grupuri hidrofilice; filtru selectiv - pe suprafața exterioară, care transmite ioni în funcție de dimensiune și formă; Poarta - pe suprafața interioară a membranei, controlează permeabilitatea canalului.
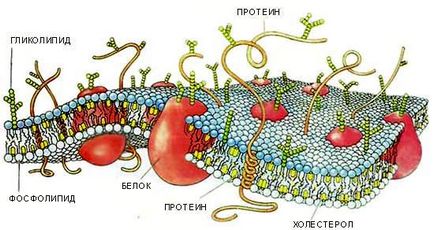
Figura 3. Structura membranei biologice.
Canalul de membrană poate fi nespecific, este în mod constant deschis, nu are mecanism de poartă, influențele electrice nu își schimbă starea. Ei numesc canalul "scurgeri". Canalele specifice (selective) au un mecanism de poartă, astfel încât acestea pot fi fie în stare deschisă, fie în stare închisă, în funcție de efectele electrice pe membrană și numai un anumit ion este trecut. Acest canal este format din trei părți: un porii de apă - căptușit în interior cu grupuri hidrofilice; filtru selectiv - pe suprafața exterioară, care transmite ioni în funcție de dimensiune și formă; poarta - pe suprafața interioară a membranei, controlați permeabilitatea canalului (figura 4).
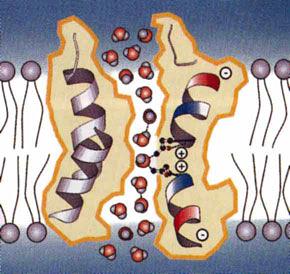
Figura 4. Structura canalului de ioni.
Canalele pentru sodiu au două tipuri de porți: activare rapidă și inactivare lentă. În repaus, inactivarea lentă este deschisă și activarea rapidă este închisă. Când este excitat, există o descoperire a activării rapide și închiderea lentă a inactivării lente, adică Pentru o perioadă scurtă de timp, ambele tipuri de porți sunt deschise (figura 5).
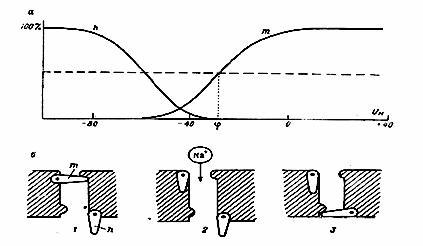
Figura 5. Activitatea mecanismelor porții de activare și inactivare a canalului de ioni de sodiu.
Canalele de canal au numai porți lente.
Pompele îndeplinesc funcția de transport prin membrana ionică împotriva gradientului de concentrație, energia ATP este folosită pentru munca lor.
- Există un gradient de concentrație pe ambele părți ale membranei.
În celula de 40 de ori> K +; t; / p>
În afara celulei: 20-30 ori> Na +,
în 50 de ori> Cl-.
- Membrana trece moleculele de substanțe solubile în grăsimi, iar anionii de acizi organici nu trec. Membrana este permeabilă la apă, pentru ioni permeabilitatea membranei este diferită: pentru potasiu în repaus, permeabilitatea este de aproape 25 de ori mai mare decât pentru sodiu. În timpul excitației, permeabilitatea crește atât pentru potasiu (treptat), cât și pentru sodiu (rapid, dar pentru o perioadă foarte scurtă de timp).
Posibilitatea de odihnă
Permeabilitatea membranei pentru ionii K + este crescută, astfel că potasiul joacă un rol major în generarea MPP. Potasiul creează un câmp electric și încarcă suprafața exterioară a membranei "+". In momentul in care „+“ potențial al părții exterioare atinge o anumită valoare în raport cu „-“ în care este generat anioni - vine echilibru dinamic între intrare și ieșirea din celula K + ioni. Acest moment corespunde potențialului de echilibru pentru K, potențialul de odihnă.
MPP se caracterizează prin:
1. constanță;
2. polaritatea, în afara "+", în interiorul "-";
3. magnitudine - în mV, pentru mușchii scheletici - 60 - 90 mV,
pentru netede - -30 - 70 mV,
pentru nervul -50 - 80 mV,
pentru celula secretoare - -20 mV.
MPP - unul dintre principalii indicatori ai stării de stagnare fiziologică a celulei. Cu o creștere a concentrației de potasiu extracelular, MPP scade, difuzia de potasiu din celulă scade datorită scăderii gradientului său de concentrație. Prin acțiunea substanțelor care blochează resinteza ATP, t. funcționarea pompei sodiu-potasiu se oprește, iar MPP scade. Ionii de sodiu și clor intră în celulă, dar datorită permeabilității scăzute, nu au un efect semnificativ asupra MP.
Potențial de acțiune
In timpul excitare - crește dramatic (mai multe mii de ori) permeabilitatea la ionii de Na care intră în avalanșă de celule și încărcați interiorul „+“ - există depolarizarea membranei, și apoi cantitatea de ioni de sodiu este mai mare în interiorul taxa de potasiu la suprafață și acest lucru determină reîncărcarea membranei (reversie). Creșterea progresivă a permeabilității pentru potasiu și a fluxului său din celulă inactivează permeabilitatea sodică și duce la o reducere a încărcării pe membrană. Există o fază de repolarizare.
Un factor esențial este pompa de sodiu-potasiu, care îndepărtează 3 ioni de sodiu din celulă în schimbul a doi ioni de potasiu injectați în celulă. Activitatea sa depinde de metabolismul celulei, în special de aprovizionarea cu energie. În acest caz, o moleculă de ATP este consumată (figura 6).
Figura 6. Mecanismul de funcționare a pompei de sodiu-potasiu.
PD constă dintr-un potențial de vârf, care este format dintr-o fază de depolarizare, reversiune și repolarizare și potențiale de urmărire (figura 2).
Potențiale de urmărire:
Negativ (depolarizarea urmelor);
Pozitive (hiperpolarizarea urmelor).
Cauza potențialelor de urmărire reprezintă schimbări ulterioare în raportul dintre intrarea sodiului în celulă și eliberarea de potasiu din acesta. Cu depolarizarea urmei, curentul rezidual de sodiu din celulă este notat, în timp ce curentul de potasiu scade simultan. În cazul hiperpolarizării urmelor, creșterea reziduală a curentului de potasiu din celulă, cu activarea simultană a pompei de potasiu de sodiu.
PD se caracterizează prin:
1. un caracter în schimbare;
2. pe termen scurt - câteva milisecunde;
3. încărcarea membranei, în afara - "-", în interiorul - "+".
Prin acțiunea substanțelor care blochează canalele de sodiu, PD nu este generat, deoarece în depolarizarea normală a membranei datorită creșterii permeabilității sale la sodiu. Când puterea stimulului este crescută peste prag, amplitudinea PD nu se schimbă; Numărul de canale de sodiu activate care se desfășoară maxim în timpul stimulării pragului nu se modifică.
Condiții necesare declanșării excitației (legi de iritare).
Excitabilitatea țesuturilor este diferită. Pentru a provoca stimularea, stimulul trebuie să posede:
1. Puterea suficientă este legea pragului.
2. Înclinația (gradientul) creșterii acestei forțe este legea locuinței.
3. Timpul acțiunii este legea vigoare-timp.
1. Legea forței. Măsura excitabilității este pragul de stimulare - forța minimă de stimulare care poate provoca excitația. Toți stimulii pot fi împărțiți în sub-prag, prag și super-prag. Prin semnificație biologică, stimulii sunt împărțiți în condiții adecvate (care acționează asupra țesutului în condiții naturale, la care este adaptat în procesul evoluției) și inadecvate. În experimentele fiziologice, curentul electric este folosit cel mai adesea ca iritant, deoarece provoacă modificări reversibile, este ușor de dozat prin rezistență și durată, prin natura sa este aproape de procesele electrice care apar în organismele vii.
In 1870 g Bowditch în mușchiul cardiac experimental prin aplicarea pe acesta a stimulărilor prag singur răspuns înregistrat. - a stabilit că reacția de stimulare subliminală nu a fost la prag și forța suprathreshold amplitudinea răspunsului a fost același. Pe baza acestui lucru, el a propus legea "Toată sau nimic".
După introducerea în studiile experimentale ale tehnologiei microelectronice, sa constatat că o stimulare subthreshold în țesut generează un răspuns. Dacă forța este mai mică de 50% din pragul de stimulare, apoi sub pasiv polii electrozi depolarizarea se produce fără a altera permeabilitatea membranei pentru ioni (schimbarea electrotonic). Dacă forța este mai mică decât stimul de prag, dar mai mult de 50% din ea, atunci există un răspuns tisular local, care este însoțită de depolarizarea membranei în aplicarea iritație și nu acoperă întregul țesut țesuturilor excitabile în această porțiune a crescut. Răspunsul local este supus legii relațiilor de putere, adică Cu cât puterea stimulului subthreshold este mai mare, cu atât este mai mare amplitudinea răspunsului local. Permeabilitatea membranei celulare din această regiune crește pentru ionii de sodiu. Atunci când se aplică un stimul de prag, apare un PD, a cărui amplitudine nu se modifică dacă stimulul depășește valoarea pragului, adică corespunde legii "Totul sau nimic", dar pentru stimulii super-prag, durata PD va fi mai mică datorită scurgerii duratei răspunsului local.
Momentul de tranziție a răspunsului local din PD se numește nivelul critic de depolarizare (FPR), și o membrană cu o schimbare de încărcare a potențialului de membrană de ASCs, numit potențial de prag, acesta, împreună cu pragul de stimulare caracterizează excitabilitatea țesutului.
Schimbarea excitabilității țesuturilor în timpul excitației.
Când este excitat, excitabilitatea țesuturilor suferă anumite modificări ca funcție a fazelor PD (figura 7):
I - excitabilitatea supranormală (primară) corespunde unui răspuns local, în timp ce doi stimuli subthreshold aplicați cu un interval de timp mai scurt decât durata răspunsului local pot fi rezumați și cauza PD;
II - refractare absolută - corespunde depolarizării și reversiei regenerative, în timp ce țesutul devine absolut inexprimabil și nu răspunde celor mai puternici stimuli;
III - faza refractară relativă, corespunde repolarizării, excitabilitatea țesutului este restaurată treptat și stimulul super-prafic aplicat în această perioadă poate genera PD;
IV - excitabilitate supranormală (faza secundară sau de expirare) - depolarizarea urmelor, țesutul devine mai excitabil decât în starea inițială și chiar stimulul subthreshold este capabil să inducă PD;
V - excitabilitate subnormală - hiperpolarizarea urmelor, excitabilitatea țesuturilor este oarecum redusă.
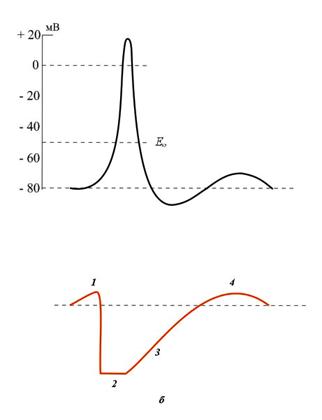
Figura 7. Modificări ale excitabilității membranei în dezvoltarea potențialului de acțiune.
2. Legea gradientului de stimulare (Dubois Raymond). Cu cât gradientul de iritare este mai mare, cu atât mai mult (până la anumite limite) reacția formării vii.
În timpul stimulului care se dezvoltă încet vine adaptarea țesutului. Aceasta este legată de faptul că, atunci când permeabilitatea excitație pentru ionii de sodiu este crescută pentru o perioadă scurtă de timp, în cazul în care în cadrul stimulilor nu atinge pragul, apoi crescând permeabilitatea la ionii de potasiu inactiva permeabilitate de sodiu și de excitație nu se produce. În același timp, există și o schimbare în ACD cu o creștere a potențialului de prag.
3. Legea vigoare-timp (Lapik). Valoarea prag a oricărui stimul este invers proporțională cu timpul acțiunii sale, care se caracterizează printr-o curbă matematică - o hiperbolă. Caracterul curbei indică faptul că stimulii subliminale (mai puțin de 1 rheobasis) nu va cauza excitarea cât timp nu ar fi acționat în același timp, foarte puternic stimul pe termen scurt, a cărui durată este mai puțin timp util, de asemenea, nu va cauza excitarea.
Puterea unui curent direct, care, acționând pe termen nelimitat, provoacă excitația, se numește reobaza.
Timpul în care curentul în 1 reobaza provoacă excitația este un timp util.
Timpul minim în care un curent de 2 rheobaze va provoca excitație se numește cronaxie. Studiul acestui indicator este folosit în practica neurologică și traumatologică pentru a studia dinamica recuperării în țesutul nervos sau muscular după traumatism.