8. Compușii cei mai importanți de calciu obținuți în industrie.
Oxidul de calciu este produs în industrie prin calcinarea calcarului:
oxid de calciu - ridicate de topire solid alb (topește la 2570 0 C), are proprietăți chimice specifice oxizilor de bază ale metalelor active (I, tabelul II, 88 ..) [14].
Reacția de oxid de calciu cu apă are loc cu eliberarea unei cantități mari de căldură:
Oxidul de calciu este constituentul principal al prafului negru, iar hidroxidul de calciu este ars de var.
Reacția de oxid de calciu cu apă se numește stingerea varului.
Oxidul de calciu este utilizat în principal pentru producerea de var hidratat.
Hidroxidul de calciu Ca (OH) 2 are o mare importanță practică. Se folosește sub formă de var stins, lapte de var și apă de var.
Var nestins - pulbere subțire în vrac, de obicei gri (parte hidroxid de calciu), puțin solubil în apă (1,56 g dizolvate în 1 litru de apă la 20 0 C). amestec cu aspect de aluat a fost var stins la ciment, apă și nisip utilizate în construcții. Treptat, amestecul se întărește:
Varful de lapte este o suspensie (suspensie), similar laptelui. Se formează prin amestecarea excesului de var stins cu apă. Aplicați lapte de var pentru producerea de înălbitor, în producția de zahăr, pentru prepararea amestecurilor necesare în lupta împotriva bolilor plantelor, pentru albirea trunchiurilor de copaci.
Apa calcare este o soluție transparentă de hidroxid de calciu, obținută prin filtrarea laptelui de var. Utilizați-l în laborator pentru a detecta monoxidul de carbon (IV):
Cu transmiterea prelungită a monoxidului de carbon (IV), soluția devine transparentă:
Dacă soluția transparentă de bicarbonat de calciu rezultată este încălzită, atunci turbiditatea apare din nou:
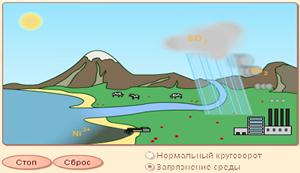
Procese similare au loc și în natură. Dacă apa conține monoxid de carbon dizolvat (IV) și acționează asupra calcarului, atunci o parte din carbonatul de calciu este transformată în carbonat acid de calciu solubil. Pe suprafata, solutia se incalzeste, iar carbonatul de calciu iese din solutie.
8. Gypsum. Există următoarele tipuri de gips: natural - CaSO4 # 8729; 2H2O, ars - (CaS04) 2 # 8729; H20, CaS04 anhidru.
Gipsul gastric (semi-acvatic) sau alabastru (CaSO4) 2 # 8729; H20 este obținut prin încălzirea gipsului natural la 150-180 ° C:
Dacă amestecați pulberea de alabastru cu apă, atunci se formează o masă plastică semi-lichidă, care se întărește rapid. Procesul de solidificare se explică prin adăugarea de apă:
Proprietatea gipsului ars este folosită pentru a se solidifica în practică. De exemplu, alabastrul amestecat cu var, nisip și apă este folosit ca tencuială. Produsele artificiale sunt fabricate din alabastru pur, iar în medicină se utilizează pentru aplicarea pansamentelor de gips.
În cazul în care CaSO4 gips natural # 8729; 2H2 O se încălzește la o temperatură mai ridicată, apoi se eliberează toată apa:
Calciul anhidru CaS04 rezultat nu mai este capabil să atașeze apă și, prin urmare, a fost numit gips mort.
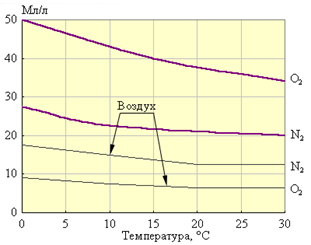
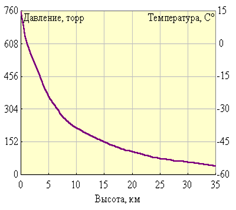
9. Duritatea apei:
Duritatea apei și căile de eliminare a acesteia
IV. Consolidarea cunoștințelor (5-7 min.)
1. Ce este scârțâitul și praful și unde sunt folosite?
2. Cum obții gips?
5. Ce funcții face calciul în corpul uman?
6. Cum poate fi eliminata duritatea carbonatului?
7. Cum să scapi de duritatea necarbonatată?
V. Tematica (2-3 minute)
Răspundeți întrebărilor și faceți exercițiile 1-15, § 48.49, rezolvați exercițiile 1-4, pp. 132-133 [14].
Rezultatele testelor sunt prezentate în Tabelul. 3.
1. Sa realizat o revizuire a literaturii de specialitate pe tema muncii de calificare.
2. Materialul ecologic a fost selectat pentru a studia subiectul "Calciu și compușii săi" în ciclul de școală de chimie din clasa a IX-a.
5. Revizuirea literaturii și Apendicele 1 conțin materiale pe care profesorii le pot folosi pentru a lecta lecțiile de chimie din școlile rurale.
6. Sarcinile și testele prezentate în anexa 1 pot fi utilizate pentru activitățile de control.
Rezultatele studiului în liceu p. Experiența Karasu a arătat o îmbunătățire a asimilării materialului de către elevii școlari, care a contribuit la dezvoltarea educației ecologice a elevilor și a extins cunoștințele lor în domeniul protecției mediului
6. Metzler D. Biochimie. Reacții chimice într-o celulă animală / în 3 volume, vol. 1, M. Mir, 407 p.
9. Orientări pentru diagnosticarea clinică de laborator. Partea 3. Biochimia clinică / Ed. MA Bazarnova, V.T. Morozova. Școala lui K. Vishcha, 1986, 279 p.
12. Alb A. Hendler F. Smith E. Hill R. Leman I. Fundamentele biochimiei / În 3 volume, vol. 3, trans. cu engleza. M. Mir, 1981, 726 p.
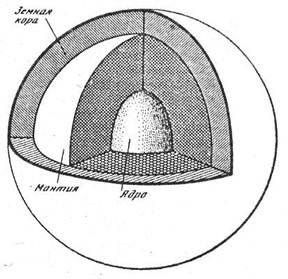
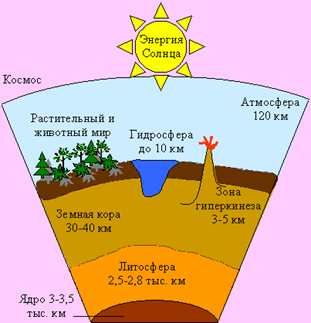
Fiind în natură
Informații despre lucrare "Posibilitățile de educație ecologică a elevilor la studierea temei:" Calciu și compușii săi "
Sectiune: Pedagogie
Numărul de caractere cu spații: 64057
Număr de tabele: 6
Număr de imagini: 3
[13]. Această idee unificatoare a fost manualul "Istoria naturală", clasa a Va, editat de către T.S. Sukhova, V.N. Stroganov [12]. Conceptul de manuale: Formarea conceptelor studenților și a conceptelor de integritate și natura sistemică a lumii materiale este una dintre cele mai dificile sarcini ale educației științelor naturale. Principala problemă este cum să dezvălui cele mai complexe fundații ale științei naturale disponibile pentru înțelegerea copiilor.
activitate. Căutarea metodelor și a formelor de învățare care contribuie la creșterea unei personalități creative a condus la apariția unor modalități specifice de predare, dintre care una este o metodă de joc. Implementarea metodelor de învățare a jocurilor de noroc în studiul chimiei în condițiile respectării caracteristicilor didactice și psiho-pedagogice, crește nivelul de pregătire a studenților. Cuvântul "joc" în rusă.
și cerințele igienice); • Corespondența încărcăturii educaționale și fizice cu abilitățile de vârstă ale copilului; • condiții de motor necesare, suficiente și raționalizate. În cadrul tehnologiei educaționale de salvgardare (Petrov) înțelege un sistem care creează cele mai multe condiții posibile pentru conservarea, întărirea și dezvoltarea intelectualului spiritual, emoțional, intelectual.