În celulele oamenilor și animalelor, glicogenul este un material energetic rezervat. Mai ales multe dintre ele în celulele ficatului și a mușchilor. În corpul adult pot conține până la 450 de grame de glicogen.
Glicogenul este sintetizat în timpul digestiei (1-2 ore după administrarea carbohidraților alimentelor). Sinteza glicogenului ca orice proces de sinteză necesită cheltuieli de energie. Glucoza care intră în celulă este fosforilată, ducând la formarea de glucoz-6-fosfat. Catalizează procesul enzimă-hexokinază. Mai departe, glucoză 6-fosfat de enzima - fosfoglucomutază transformată în glucoză 1-fosfat, care este apoi de enzima UDP-glucoza este convertit în UDP-glucoză. Această reacție necesită participarea unui nou compus macroergic - UTP (reacția este ireversibilă). Deoarece glicogen în celulă nu ar trebui să fie scindată complet, sinteza glicogenului este realizată prin extinderea moleculei de glicogen existent denumit „primer“, care constă din 4 sau mai multe resturi de glucoză, ca fragmente mai scurte „nu poate fi identificat“ enzimă și procesul de sinteză a glicogenului oprește, ceea ce duce în cele din urmă la moarte corpul.
Substratul utilizat pentru a lărgi lanțurile de glicogen este UDF-glucoza. Rolul "însămânțării" poate fi de asemenea realizat de glicozidaze cu grade diferite de polimerizare sau de precursori de proteine, la care se atașează, în mod preliminar, reziduurile de glucoză. Catalizează procesul de alungire a lanțurilor de glicogen, principala enzimă de reglementare pentru sinteza glicogenului - glicogen sintetazei.
Glicogen sintetaza extinde ramura nereducătoare a glicogenului pentru a se forma # 945; -1,4-glicozidice până când nu există cel puțin 11 resturi de glucoză în lanț înainte de locul ramurii. După aceea, se pune în joc așa-numita enzimă "ramificată". Ea catalizează transferul fragmentului de oligozaharidă terminală constând din 6-7 resturi de glucoză din capătul nereducător al lanțului, numărând cel puțin 11 resturi de glucoză în acest echilibru intern de glucoză sau alte lanț pentru a forma în locul legăturii 1,6-glicozidică și, prin urmare, apariția de noi ramificare. După această glicogen sintetază se pot adăuga la catena laterală resturi de glucoză noi.
Calea principală sau principală pentru descompunerea glicogenului este fosfoliza glicogenului sau glicogenolizei. Descompunerea glicogenului se produce ca răspuns la creșterea necesității organismului de glucoză.
Inițial, glicogen-1-fosfatul este scindat din glicogen sub acțiunea glicogenului fosforilazei active (fosforilate). Procesul continuă folosind fosfat anorganic. Pe lângă sinteza, scindarea glicogenului începe cu ramuri de polizaharidă nereducătoare. Glicogenul fosforilază atacă din nou și din nou sucursalele nereducătoare ale glicogenului până când ajunge la punctul care este de patru unități de glucoză distanță de # 945; -1,6-glicozidică. Aici acțiunea enzimei încetează. După aceea, așa-numita enzimă "debranching" începe să acționeze asupra glicogenului în această zonă, care are două activități enzimatice diferite - transferază și glucozidază. Cu această enzimă, restul resturilor de glucoză rămase înaintea punctului de ramificație sunt transferate în orice ramură nereducătoare, extinzându-l. Reziduul de glucoză rămas la punctul de ramificație este apoi scindat hidrolitic pentru a forma glucoză liberă. Produsul de acțiune al glicogen fosforilazei-glucoz-1-fosfat sub acțiunea fosfoglucomutazei este transformat în glucoz-6-fosfat. Mai mult, glucoza-6-fosfat este inclusă în procesele de catabolizare sau alte căi metabolice. În celulele hepatice, acesta poate fi hidrolizat de către enzima glucoză-6-fosfatază la glucoză liberă, care poate intra apoi în sânge. În mușchii scheletici, această enzimă este absentă, astfel încât glucoza-6-fosfat este folosită de mușchi pentru a produce energie în procesul de catabolism de glucoză-glicoliză.
Reglarea sintezei și descompunerii glicogenului se realizează reciproc. reglementarea reciprocă înseamnă că unul și același efect de reglementare a secțiunii transversale asupra enzimelor glicogen sintaza și glicogen fosforilază (fosforilare sau defosforilare) determină activarea uneia dintre aceste enzime din inactivarea sincronă alta. Controlați intensitatea proceselor de fosforilare - defosforilare în celule - hormoni (insulină, glucagon, adrenalină). De exemplu, fosforilarea secțiunii transversale a glicogen și glicogen fosforilaza are ca rezultat activarea și inactivarea glicogen fosforilazei glicogen, ducând la începutul procesului de descompunere sinteza glicogenului și oprirea acestuia din urmă.
Pancreatic hormone - insulina sporește procesele de defosforilare în celule, prin urmare, oprește procesele de descompunere a glicogenului și sporește sinteza acestuia. În celulele hepatice, insulina induce sinteza glucokinazei, o enzimă care catalizează formarea glucozei-6-fosfatului când concentrația de glucoză în sânge este mare. Prin urmare, sinteza glicogenului din ficat este activată după un timp după ingestia alimentelor care conțin carbohidrați.
Inhibitorii de insulină asupra efectelor biologice ale glucagonului și adrenalinei asupra mecanismelor în cascadă sporesc procesele de fosforilare în celule, mărind astfel distrugerea glicogenului și inhibând biosinteza acestuia.
Pentru că pe celulele hepatice, cu excepția Sunt, de asemenea, 2-adrenoreceptorii Adrenoreceptorii 1-adrenalina au capacitatea de a spori distrugerea glicogenului folosind ioni de calciu (activează proteinele care leagă Ca + 2 și, în cele din urmă, sporesc fosforilarea).
În mușchiul încrucișat încrucișat, enzima kinaza fosforilază are particularități, această enzimă conține centrul de legare a ionilor de calciu.
Cu o creștere a concentrației de ioni de calciu în sarcoplasmă la momentul contracției musculare, ionii de calciu se leagă de fosforilază kinază și o activează. Ca urmare, activitatea musculară accelerează descompunerea glicogenului la glucoz-6-fosfat, iar acesta din urmă este utilizat pentru a produce energie în procesul de glicoliză. Energia ATP este folosită pentru a efectua lucrul cu mușchii.
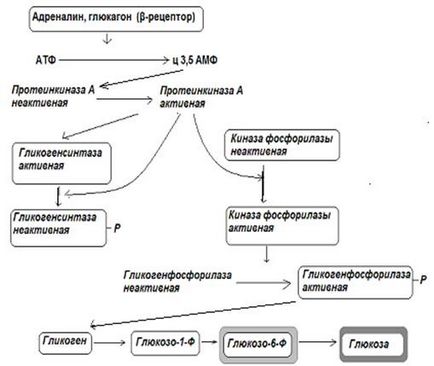
Fig. 12-1. Reglarea sintezei și descompunerii glicogenului în ficat cu glucagon și adrenalină.
(Radical P-acid fosforic)
Glicogenele sunt boli ereditare cauzate de un defect al enzimelor implicate în metabolismul glicogenului.
Boala Girke (de tip I) - cauza este un defect ereditar de glucoză-6-fosfatază. Boala lui Girke se manifestă prin hipoglicemie, creșterea valorilor trigliceridelor în sânge, hiperuricemie (creșterea acidului uric în sânge). Acidoză posibilă.
Boala Pomp - activitate scăzută sau lipsă de lizozomal # 945; -1,4- și # 945; -1,6-glicozidaze. Ca rezultat, glicogenul începe să se acumuleze în lizozomi.
Boala lui Forbes sau Corey (tip III) este foarte frecventă. Sunt ¼ din toate cazurile de glicogenă hepatică. Glicogenul acumulat este anormal, deoarece enzima "debranching" este defectă. Lipsa de glucoză în sânge apare rapid. Spre deosebire de glicogenoza de tip I, acidoza lactică și hiperuricemia nu sunt observate.
Boala Andersen (tip IV) - este rară. Cu această boală, activitatea enzimei "ramificate" este scăzută sau complet absentă. Boala se dezvoltă rapid și practic nu se dă la tratament.
Boala Mac Ardl (tip V) - manifestată prin absența glicogenului fosforilazei musculare. Pacienții sunt încărcări foarte slabe ale mușchilor.
Boala bolii (tip VI) - se manifestă prin simptome cauzate de leziuni hepatice. Această glicogenă este o consecință a unui defect al glicogenului fosforilazei. În hepatocite, se acumulează glicogen de structură normală.
Boala Tardi (tipul VII) se datorează unui defect al enzimei fosfofructokinază în eritrocite și mușchii striați. Pacienții pot efectua doar exerciții moderate.
Rareori, glicogenii se dezvoltă datorită defectelor enzimelor: proteină kinază A, fosforilază kinază, fosfoglicerol mutază și subunitatea M a lactatului dehidrogenazei.
Glicoliza - calea de catabolism de glucoză are următoarea semnificație:
Eu este calea care dă energie celulelor. Pentru celulele care funcționează în condiții anaerobe sau în absența mitocondriilor, aceasta este singura modalitate de a genera energie sub formă de ATP.
II - Unii metaboliți ai glicolizei pot fi utilizați pentru biosinteza aminoacizilor și lipidelor interschimbabile (PVK, fosfat de dihidroxiacetonă).
Există două etape în glicoliza:
1. Etapa pregătitoare, în timpul căreia glucoza este fosforilată și clivată în două molecule de fosfotoză. Această serie de reacții are loc cu costul a două molecule ATP.
2. Faza, cuplată cu sinteza ATP. Ca urmare a acestei serii de reacții, fosfototrizele se transformă în piruvat. Energia eliberată în această etapă este utilizată pentru sinteza ATP.
Prima etapă a glicolizei începe cu reacția de fosforilare a glucozei cu participarea ATP, a ionilor de magneziu și a enzimei hexokinază. În celulele ficatului există un alt tip de hexokinază, numită glucokinază. Glucokinase, spre deosebire de hexokinaza, specific numai pentru D-glucoză, glucoză-6-fosfat nu este pentru ea inhibitor, are o valoare ridicată de K m, ceea ce crește concentrația de glucoză în celulele hepatice in forma fosforilate, în mod corespunzător la nivelul său în sânge portal .
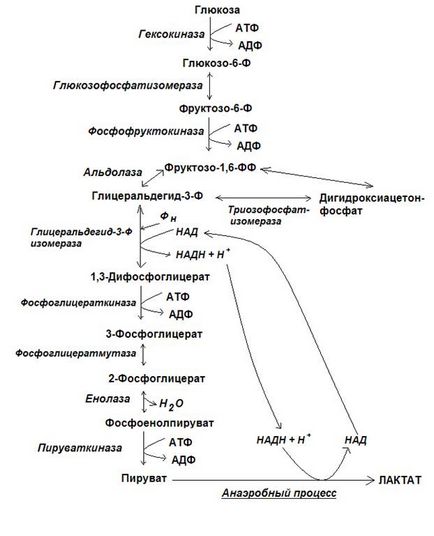
A doua reacție este reacția de izomerizare: glucoza-6-fosfat este transformată în fosfat de fructoză-6 prin enzima izomerază de glucoză fosfat. Reacția este reversibilă.
A treia reacție este o reacție ireversibilă - a doua reacție de fosforilare continuă cu costul ATP și principala enzimă de reglare a glicolizei - fosfofructokinazei -1 (PFK-1) catalizează acest proces. Această enzimă are 7 până la 12 situsuri de legare la suprafață. FFK-1 activează concentrații mari de ADP și, în special, AMP, dar inhibă: concentrații ridicate de ATP, citrat, acizi grași liberi.
A patra reacție, reacția de scindare a fructoză-1,6-difosfatului, se desfășoară sub acțiunea enzimei aldolazei. Reacția este reversibilă. În timpul acestei reacții se formează două triizofosfați: fosfat de gliceraldehidă și fosfat de dihidroxiacetonă.
Cea de-a cincea reacție, reacția de izomerizare reversibilă, are loc sub acțiunea enzimei triose fosfat izomeraza. Reacția este mutată spre formarea gliceraldehid-3-fosfatului, deoarece acesta din urmă este implicat continuu și ușor în transformările ulterioare. Astfel, putem presupune în mod condiționat că prima etapă a glicolizei este completă prin formarea a două molecule de gliceraldehidă-3-fosfat dintr-o moleculă de glucoză.
În a doua etapă a glicolizei, se formează 2 molecule de gliceraldehidă-3-fosfat din 2 molecule de PVK, 2 molecule de NADH + H + și 4 ATP.
reacția a șaptea - reacția de fosforilare a substratului este mediată de o enzimă - fosfoglicerat - 1,3-difosfogliceratului reacționat cu ADP și ATP-ul produs și 3-fosfoglicerat.
Cea de-a opta reacție, reacția de transport intramolecular, se efectuează cu fosfoglicerat mutaza enzimei. În timpul acestei reacții, reziduul de acid fosforic se deplasează de la poziția 3 la al doilea și se formează 2-fosfogliceratul.
A noua reacție este o reacție de deshidratare. Ca urmare a acestei reacții, un compus macroenergetic, fosfoenolpiruvat (PEP), este format din 2-fosfoglicerat. Catalizează reacția enzimei enolase.
A zecea reacție este reacția celei de-a doua fosforilare a substratului. Reacția este ireversibilă. Catalizează procesul enzime-piruvat kinază. Soarta NAD restaurată și PVK formate în timpul glicolizei depinde de modul în care celulele funcționează - în aerobi sau anaerobi. În condiții anaerobe, PVK este redus la acid lactic utilizând NADH + H + formată în timpul glicolizei. NAD după aceasta este returnată procesului și, prin urmare, glicoliza nu este întreruptă (oxidoreducție glicolitică).
În condiții aerobe, acidul piruvic, obținut în timpul glicolizei, se descompune în mitocondrii, în general, în catabolism la CO2 și H2O, dând energie (ATP).
NADH + H +. formată în timpul oxidării gliceraldehid-3-fosfatului în procesul de glicoliză aerobă suferă oxidare prin transferul atomilor de hidrogen în lanțul respirator mitocondrial. Totuși, NADH + H + citosolic nu este capabil să transfere hidrogenul în lanțul respirator, deoarece lanțul mitocondrial este impenetrabil pentru acesta. Transferul de hidrogen prin membrană are loc prin intermediul unor sisteme speciale denumite sisteme de transfer. În aceste sisteme, hidrogenul este transportat prin membrană cu participarea perechilor de substraturi legate de dehidrogenazele corespunzătoare. Sunt cunoscute două sisteme de transfer.
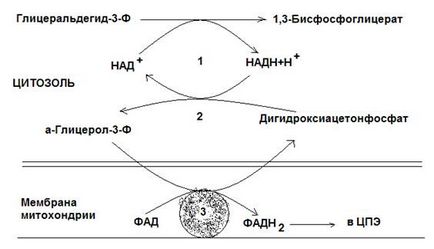
Fig. 12-3. Sistemul de transfer al glicerofosfatului.
2-glicerol-3-fosfat dehidrogenază (enzima citosolică, denumită după reacția inversă);
3-glicerol-3-fosfat dehidrogenază (enzima mitocondrială).
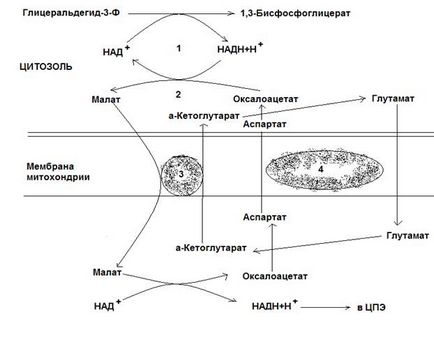
Ris.12-4. Sistem de transfer malate-aspartat.
În primul dintre aceste sisteme de NADH citosolic hidrogen transmise fosfat dihidroxiacetonă de dehidrogenaza glicerol-3-fosfat (enzimă NAD dependentă numita reacție inversă). Formată în cursul acestei reacții, glicerol-3-fosfat este oxidat mai enzima interioara mitocondriale cu membrana - glicerol-3-fosfat dehidrogenază, enzimă dependentă de FAD). Apoi, protonii și electronii cu FADH2 comută la ubiquinone și apoi prin lanțul de transfer de electroni (CPE).
Sistemul de transfer de glicerol fosfat funcționează în celulele musculare albe și hepatocite.
Cel de-al doilea sistem de transfer, în care sunt implicate malatul, citozolul și malatul dehidrogenazei mitocondriale, este mai universal. În citoplasmă NADH restabilește oxaloacetat în malat, care, cu ajutorul suportului are loc în mitocondrii, care este oxidat la oxaloacetatului NAD dependentă malat dehidrogenază. NAD recuperat în timpul acestei reacții dă hidrogen la CPE mitocondrial. Cu toate acestea, format din malat oxaloacetat le retrage din mitocondriile citosolului nu se poate, deoarece membrana mitocondrială este impermeabilă la el. Prin urmare, oxaloacetatul este transformat în aspartat, care este transportat la citozol, unde este transformat înapoi în oxaloacetat. Transformarea oxaloacetatului în aspartat și viceversa este asociată cu adăugarea și scindarea grupării amino (reacție de transaminare). Acest sistem de transfer este numit malat-aspartat. Rezultatul lucrării sale este regenerarea NAD-ului citoplasmatic din NADH.
Sistemele shuttle diferă în ceea ce privește cantitatea de ATP sintetizată. În primul sistem, raportul P / O este 2, deoarece hidrogenul este introdus în CPE la nivelul KoQ. Al doilea sistem este mai eficient din punct de vedere energetic, deoarece transferă hidrogenul către CPE prin NAD mitocondrial, iar raportul P / O este aproape de 3.
În oxidarea anaerobă a glucozei, randamentul ATP este de două molecule.
În oxidarea aerobă a glucozei, randamentul ATP este 38 ATP (mecanismul de aspartat de malat) sau 36 ATP (mecanismul # 945; -glicerol-3-fosfat).
Reglarea glicolizei se efectuează prin schimbarea activității unui număr de enzime de reglare: fosfofructokinază -1 (PFK-1), piruvat kinază, hexokinază.
Activitatea PFK-1 este crescută: creșterea concentrațiilor de ADP și AMP, fructoză-2,6-difosfat și a redus - creșterea concentrației de ATP, citrat, acizi grași liberi, NADH.
Activitatea hexokinazei reduce creșterea concentrației de glucoz-6-fosfat (observată atunci când activitatea PFK-1 scade).
Activitatea piruvat kinazei crește concentrația ridicată de ADP, AMP; reduce activitatea enzimei - concentrații ridicate de ATP, NADH.
Glicoliza poate fi, de asemenea, supusă unei reglări lente prin schimbarea concentrației de enzime, care se efectuează cu ajutorul hormonilor: astfel, insulina stabilizează biosinteza glucokinazei, PFK-1 și piruvat kinazei.