Extracte de coroziune a fierului. continuu, local, intergranular, subacvatic, subteran, atmosferic, bio-coroziune, oboseală la coroziune.
Rezistența la coroziune a fierului.
Cele mai cunoscute tipuri de coroziune în fier și aliajele sale sunt, la fața locului, intergranulară, subacvatice, subteran, atmosferic, biocorrosion, oboseala continua coroziune și altele.
Coroziunea solidă a fierului. În H2S04 diluat, acest procedeu se desfășoară conform ecuațiilor
Fe = Fe 2+ + 2 # 275;, 2H + + 2 # 275; = H2
În soluțiile alcaline, fierul corrodes prin reacție
În prezența oxigenului în soluții neutre sau apropiate acestora, distrugerea fierului se realizează conform reacției
În acest caz se formează Fe 3+. și cu o lipsă de oxigen, se obține un ferroferit de oxid mixt (Fe3O4 x H20). Apa (1 L) saturată cu aer poate provoca coroziunea pe suprafața (1 cm2) de fier la o adâncime de> 0,022 mm. Dacă, împreună cu evoluția hidrogenului, apare depolarizarea oxigenului, se intensifică coroziunea generală (coroziunea fierului în apa de la robinet care conține CO2 este periculoasă numai în prezența oxigenului).
Local sau prin coroziunea fierului duce la apariția de crater adâncituri și prin găuri în prezența unui mediu oxidant și o substanță capabilă peliculă de oxid corodează (ionii de clor, brom, iod, cu o concentrație> 3 x 10 -4 g - ion / litru).
Oțelurile aliate cu siliciu, molibden și cupru au mai puține ulcere decât cele nedepășite. Astfel, în austenitice oțeluri crom-nichel în soluție 4% de NaCl (90 ° C), ulcere maxime adâncime obținute la pH = 5 ÷ 7, și cu introducerea de NaOH se reduce 0.4-0.1 g / (m2 • zi. ), iar numărul acestora scade de la 14 la 2.
Coroziunea intergranulară a fierului duce la distrugerea metalului (aliajului) de-a lungul granițelor granulelor și la separarea acestuia din urmă de masa totală a metalului (în special în soluțiile de cloruri). O variație a acestei coroziuni este coroziunea filamentoasă (aspectul incizilor înguste în apropierea îmbinărilor sudate dopate cu niobiu sau titan). Pentru a preveni coroziunea, carbonul din oțel trebuie să fie legat de carburi.
Oțelurile austenitic sunt predispuse la coroziunea intercristalină a fierului (cu un conținut de Ni mai mare de 45% fiind rezistente). Manganul și molibdenul măresc rata de coroziune și bor (chiar
0,4%) îl reduce. Coroziunea intergranulară este practic posibilă în acid sulfuric la potențiale de la 0 la +0,3 V și are un maxim la + 0,15 V. Este cauzată de epuizarea granulelor de cereale de către crom. Prin urmare, otele predispuse la coroziunea intergranulară pot fi exploatate dacă potențialul lor staționar se află în regiunea unei stări pasive stabile.
Grafitizarea fontei nu schimbă forma pieselor și apare sub straturile de rugină. Prin care fierul metalic de legătură în zonele afectate dispare și numai zăbrele grafit sau Nervurile tsementitovyh cufundat în produse de coroziune maro-negru structura spongioasă. O asemenea coroziune apare sub acțiunea soluțiilor de sare sau a acizilor slabi, precum și a solurilor acide.
Coroziunea subterană a fierului. La nivelul apei subterane și la un pH scăzut în sol, fierul este coroziv. Cu cât pH-ul solului este mai ridicat, cu atât rezistența sa electrică este mai mare și coroziunea este mai slabă. Corodarea armăturii din oțel în beton are un caracter electrochimic. Porii și crăpăturile rezultate în beton sunt umplute cu apă saturată cu hidroxid de calciu din beton. În același timp, coroziunea armăturii este sporită de accesul inegal al oxigenului atmosferic la diferite zone ale suprafeței acestuia, precum și de prezența clorurilor în aer și umiditate.
Scara rulantă, având funcții catodice, accelerează coroziunea. Cea mai bună protecție a armăturilor din beton din coroziune este o acoperire cu zinc cu pasivare cromată. Oțelul de oțel în contact cu cuprul corrodes la o rată de 0,43 - 1,52 mm / an, cu nichel - 0,05 - 0,15 mm / an.
Coroziunea atmosferică a fierului. Mecanismul de coroziune a oțelurilor carbonice și aliate slab este inițial caracterizat prin următoarele reacții:
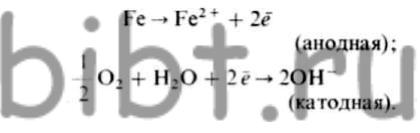
Dacă mediul care conține Nones Fe 2+, este alcalin, ionul hidroxil format prin reacția catodică la lotul anod care intră, ca materie primă da hidroxid alb:
În soluțiile care sunt în atmosferă de aer, Fe (OH) 2 este ușor oxidat la FeO (OH) sau Fe3 O4 ca o funcție a pH-ului soluției. În soluții puternic alcaline formate 4Fe (OH) 2 + O2 -> 4FeO (OH) + 2H2O, în 6Fe alkalescent (OH) 2 + O2 -> 2Fe3 O4 + 6N2 O. Atunci când o soluție apoasă pe suprafața metalică are o reacție neutră sau ușor acidă, Se formează numai complexe de hidroxil-oxigen de Fe (II). In atmosfera zonele industriale care conține dioxid de sulf, se formează rugina verde (Fe-II) pe suprafața metalică, care oxidează apoi, întorcându-se spre un oxid negru de Fe3 O4.
Coroziunea prin imersie a fierului. Prin concentrația de sare, apa oceanică este echivalentă
Soluție de sodiu 3,5% și pH-ul său variază de la 8,1 la 8,3. Rata de coroziune a oțelurilor de carbon din el
În sistemele de răcire cu apă, coroziunea fierului are loc prin reducerea catodică a oxigenului dizolvat. Anodurile sunt zone cu acces limitat O2 (produse de coroziune, diverse acoperiri protectoare etc.). Coroziunea are loc în urma formării ulcerelor și conduce la distrugerea finală a metalului. Rata de coroziune a oțelului este controlată de pH-ul apei. La viteze ridicate de apă, coroziunea are loc în timpul frecării și al cavitației. În primul caz, se produce daune în formă de potcoav pe oțel (în schimbătoare de căldură și alte aparate). Cavitația duce la distrugerea locală datorită impactului ca rezultat al umplerii abrupte a golurilor formate în apă în zonele cu presiune scăzută. În astfel de condiții, bicromații și nitrații măresc potențialul fierului și îl transformă într-o stare pasivă.
Petr Stepanovich Melnikov. Ghid pentru galvanizare în ingineria mecanică. 1979.