Compoziția chimică a proteinelor.
Dintre substanțele organice, celulele în primul rând în număr și valoare sunt proteine. Compoziția tuturor proteinelor include atomi de hidrogen, oxigen, azot. Multe proteine includ, în plus, atomi de sulf. Există proteine care includ și atomi de metal - fier, zinc, cupru.
Spre deosebire de alți compuși organici, proteinele au un număr de caracteristici. Mai întâi de toate, proteinele au o masă moleculară imensă. Comparați: alcool cu greutate moleculară - 46 Acid acetic - 60 benzen - 78, și albumina (ouă de o proteină) - 36 000 de hemoglobină (proteina de celule roșii din sânge) - 152 000 miozinei (una dintre proteinele musculare) - 500 000. Este clar că, în comparație cu moleculele de alcool, acid acetic, benzen și alte molecule de proteine giganți. Mii de atomi participă la construcția lor. Pentru a sublinia dimensiunea gigantică a acestor molecule sunt numite macromolecule (greacă „macro.“ - mare, gigant).
Structura proteinelor.
Printre compușii organici, proteinele sunt cele mai complexe. Acestea se referă la compuși numiți polimeri. Molecula polimerică reprezintă un lanț lung în care aceeași structură relativ simplă, numită monomer, se repetă de mai multe ori. Dacă monomerul este desemnat prin litera A, atunci structura polimerului poate fi reprezentată după cum urmează: A-AAA-A.
Pe lângă proteinele din natură, există și alți polimeri, de exemplu celuloză, amidon, cauciuc. În industria chimică au fost create multe polimeri artificiali - polietilenă, lavsan, capron etc.
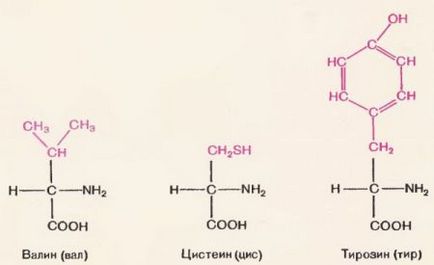
Majoritatea polimerilor naturali și artificiali sunt construiți din aceiași monomeri. Proteinele constau din monomeri identici, dar nu identici. Monomerii proteinelor sunt aminoacizi. Așa cum se poate vedea în figura 70, molecula de aminoacizi, așa cum a fost, constă din două părți. O parte (cu litere negre) pentru toți aminoacizii este aceeași.
Aceasta este o grupare. Se compune dintr-o grupare amino (-NH2) și o grupare carboxil din apropiere (-COOH). Cealaltă parte a moleculei pentru toți aminoacizii este diferită (este tipărită cu litere roșii). Această parte este numită radicală.
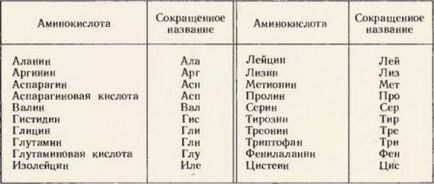
Mulți aminoacizi diferiți sunt cunoscuți. Dar numai 20 de aminoacizi sunt cunoscuți ca monomeri ai oricărei proteine naturale - animale, plante, microbiene, virale -. Ele au fost numite "magie". Lista lor este prezentată în tabel.
Faptul că proteinele tuturor organismelor sunt construite din aceiași aminoacizi este o altă dovadă a unității lumii vii de pe Pământ.
Douăzeci de aminoacizi care alcătuiesc proteine naturale (aminoacizi "magici"),
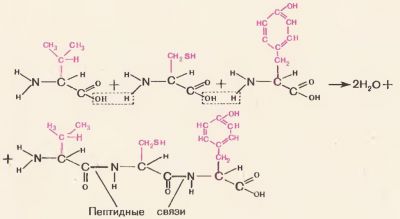
Combinația de aminoacizi în formarea moleculei de proteină se realizează printr-o grupare comună pentru toți aminoacizii. Pentru a înțelege mai bine acest lucru, ia în considerare Figura 71: din gruparea carboxil a unui aminoacid și gruparea amino a aminoacidului adiacent scindează molecula de apă și astfel valentele eliberate resturile de aminoacizi sunt unite. Între aminoacizi există o legătură covalentă puternică numită legătura peptidică. Compusul rezultat al aminoacizilor se numește peptidă. O peptidă de doi aminoacizi este numită o dipeptidă, de trei aminoacizi și o tripeptidă, de mulți aminoacizi o polipeptidă. Toate proteinele sunt polipeptide, adică lanțuri cu multe zeci sau chiar sute de unități de aminoacizi.
Fiecare organism viu conține un număr mare de proteine diferite. În acest caz, fiecare specie are propriile proteine specifice proprii acestei specii. Chiar și proteinele care îndeplinesc aceeași funcție la diferite specii de animale diferă una de cealaltă. De exemplu, toate vertebratele - pești, amfibieni, păsări, mamifere - celule rosii din sange contin hemoglobina, o proteina care efectuează toate animalele aceeași funcție - pentru a transporta oxigenul. Dar hemoglobina la fiecare specie are propriile structuri, proprietăți speciale și proprietăți diferite de hemoglobinele altor animale.
Pentru a explica posibilitatea o mare varietate de proteine, este necesar să se considere că proteinele diferă în compoziția de aminoacizi, în funcție de numărul de unități de aminoacizi, în scopul de a urmări lanțul. În același timp, numărul de variante structurale atinge cifrele astronomice. În raportul cercetătorului indian Singh, la congresul biochimic de la Moscova, sa făcut următorul calcul curios. Proteina cu o greutate moleculară de 34.000 conține aproximativ 300 de unități de aminoacizi (greutatea moleculară a unei unități de aminoacizi este de 110). Să o parte din proteine nu include toți cei 20 de aminoacizi, dar numai 12. În aceste condiții, numărul de posibili izomeri pentru această proteină este egală cu 10 300. Pentru a sesiza enormitatea acestei figuri, ne imaginăm un ban cu 10.300. Această grămadă de monede cântărește 10.300 de grame (o monedă cântărește 1 g). Masa globului este de 10 27 g!
Având în vedere că dimensiunea unității de aminoacid este 0,35-0,37 nm, este evident că macromoleculele proteina care constă din sute de resturi de aminoacizi, ar trebui să aibă o lungime de cateva zeci de nanometri. În realitate, cu toate acestea, mărimea moleculelor de proteine este mult mai mică. Unele dintre ele au forma de bile cu un diametru de numai 5-7 nm. Lanțul polipeptidic al proteinei este cumva răsucite, cumva ambalate. Fiecare proteină este caracterizată printr-o natură strict definită a stilului. Pentru a caracteriza complet structura unei molecule de proteine, este necesară cunoașterea structurilor sale primare, secundare și terțiare.
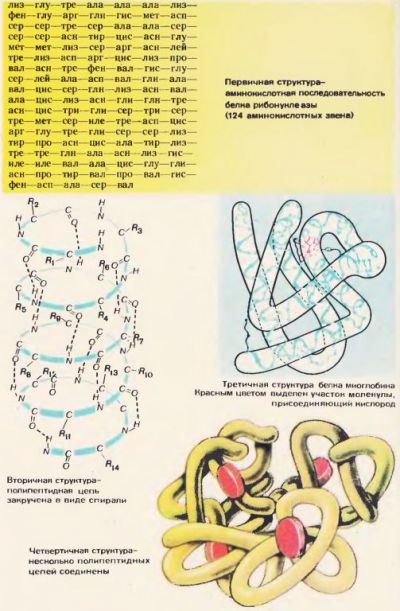
Secvența resturilor de aminoacizi din molecula de proteină determină structura sa primară. E ca o formulă de proteine. Figura 72 prezintă structura primară a proteinei ribonucleazei. Această proteină conține 124 de unități de aminoacizi. Cel mai adesea, lanțul polipeptid este în întregime sau parțial înfășurat într-o spirală. Aceasta este structura secundară a proteinei. Radicalii de aminoacizi rămân în afara helixului. Turnurile spirale sunt strâns aliniate. Legăturile de hidrogen se formează între grupurile NH pe rând și grupurile CO pe rândul adiacent (Figura 72). Legăturile de hidrogen sunt mult mai slabe decât legăturile covalente, dar, repetate de mai multe ori, ele dau o prindere puternică. Helixul polipeptidic, care a fost "cusut" de numeroase legături de hidrogen, este o structură destul de puternică.
Helix-ul polipeptidului suferă o altă aplicare. Se curbează în mod ciudat, dar pentru fiecare proteină este definitiv și permanent. Rezultatul este o configurație numită structură terțiară. Structura terțiară este susținută de legături hidrofobe care apar între radicalii de aminoacizi hidrofobi. Aceste legături sunt mai slabe decât legăturile cu hidrogen. În mediul acvatic din celulă, radicalii hidrofobi resping apa și aderă unul la celălalt. Astfel, mediul de apă, deoarece forțează molecula de proteină să-și asume o anumită structură ordonată și devine biologic activă.
Structura terțiară nu este cea mai înaltă formă de organizare structurală a proteinelor. În celula viu, multe alte forme și mai complexe ale acesteia au fost descoperite, de exemplu, cuaternar (Figura 72).