Katalizator- o substanță care nu este consumată în reacție, dar afectează viteza.
Fenomenul de schimbare a vitezei de reacție sub acțiunea acestor substanțe numite catalizei. În mod tipic, catalizatorii sunt substanțe care măresc viteza de reacție și inhibitori - substanțe care întârzie reacția. In cele mai multe cazuri, efectul catalizator se explică prin faptul că acesta scade energia de activare a reacției.
Printre numeroasele reactii chimice este izolat reacții ireversibile și reversibile.
Reacțiile care au loc într-o singură direcție și se termină într-o conversie completă a materialelor în produsele finale de pornire sunt numite ireversibile.
Condiția de reacție chimică este ireversibilă: precipitare, degajării de gaz, substanțe formarea malodissotsiiruemogo și alocarea unor cantități mari de energie. În ecuațiile de reacții ireversibile între partea stângă și dreaptă echivalate sau săgeată.
Acestea sunt numite reacții reversibile care au loc simultan în două direcții reciproc opuse.
În ecuațiile de reacții reversibile a pus două săgeți îndreptate în direcții opuse.
Reacțiile reversibile nu ajung la sfârșitul și pune capăt stabilirea echilibrului chimic. echilibrul chimic poate fi definit ca starea sistemului de reactanți, în care înainte și viteza de reacție inversă sunt egale între ele (# 965; pr = # 965; arr).
La echilibru, înainte și reacțiile inverse nu sunt convertite, astfel încât echilibrul se numește un mobil sau un echilibru dinamic.
Concentrația reactanți, care sunt instalate la un echilibru chimic, numit echilibru.
echilibru chimic se caracterizeaza prin constanta de echilibru (Kp) - raportul dintre constantele ratei de înainte și înapoi. De exemplu, pentru un sistem omogen de CO (g) + H2O (g) ↔ CO 2 (g) + H2 (g), constanta de echilibru este scris după cum urmează:
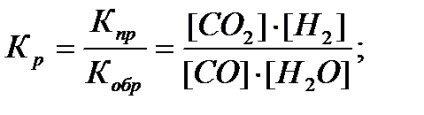
Furnizat o expresie matematică se numește legea acțiunii maselor pentru reacția chimică reversibilă.
Sistemul de reacție la lumina zilei de la starea de echilibru unul la altul se numește deplasare (sau offset) de echilibru chimic. La deplasare concentrație de echilibru chimic afectează reactanților, temperatura și substanțele gazoase - și presiunea. direcția deplasării echilibrului chimic sub influența acestor factori este determinat de poziția generală, cunoscută ca principiul echilibrului dinamic sau principiul -Brauna Le Chatelier: dacă sistemul este în echilibru, care se face-sau impactul extern, este favorabil ca fluxul de reacție care slăbește impactul .
Principiul Le Chatelier lui - de exemplu Braun reacția acidului clorhidric cu oxigen
1) Concentrațiile crescute de reactanți se va deplasa echilibrul spre fluxul acestor substanțe, adică dreapta. Scăderea concentrației reactanților - în direcția formării lor, adică, la stânga.
2) Deoarece reacția directă este exotermă, creșterea temperaturii va promova fluxul temperaturii procesului de absorbție, adică, soldul se va deplasa spre stânga. Temperatura de absorbție se va deplasa echilibrul în favoarea reacției directe.
3) Efectul presiunii asupra echilibrului este posibilă numai în sistemele de gaze, va schimba numărul de moli de substanțe gazoase. Creșterea presiunii rezultatelor într-o deplasare a echilibrului spre reacție care conduce la o cantitate mai mică de material, adică dreapta. Reducerea presiunii - la stânga.
Catalizatorii nu afectează echilibrul de deplasare chimică în sistem, din moment ce în egală măsură să modifice viteza de înaintare și reacții inverse.
Întrebări pentru auto-control
1. Ceea ce se numește viteza reacțiilor chimice în sistem omogen și eterogen. Dimensiunea vitezei de reacție chimică.
2. Identificați legea de bază a cineticii chimice - legea acțiunii de masă.
3. Ce factori influențează viteza de reacție chimică? Care este diferența în cinetica reacțiilor chimice omogene și eterogene?
4. Care este energia de activare a reacției?
5. Care este diferența dintre reacțiile chimice reversibile și ireversibile?
6. Ceea ce se numește o stare de echilibru chimic și de ce este numit dinamic?
7. Ca o regulă formulată în Le Chatelier - Brown?
8. Cum catalizatorii la echilibrul chimic al sistemului?
9. Care sunt conceptele de bază ale teoriei coliziunilor activi?
10. Ce factori afectează echilibrul chimic?