1.Fermenty sau enzime (E), - o recuperatoarele proteina kata pentru a accelera reacția în celulă.
Enzimele sunt proteine in natura, cu toate acestea, ea a descoperit abilitatea anumitor molecule de ARN pentru a efectua catalizei. Aceste ARN-uri sunt numite „ribozomi“.
2. Enzimele catalizează conversia substanțelor care sunt numite substraturi (S), produsele (P). In general, reacția enzimatică poate fi scrisă ca:
S - - - - -> F
3. Ca și alți catalizatori chimici, enzime:
viteza de reacție -uvelichivayut, dar care nu sunt consumate în timpul procesului și nu suferă schimbări ireversibile;
Nu schimba starea de echilibru a reacției chimice, accelerarea atât directă și inversă reacții la fel;
Viteză de reacție și amelioreaza scaderea energiei de activare, bariera de energie care separă un stat dintr-un alt sistem.
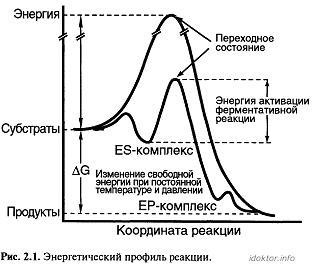
Exemplul 1. Un catalizator modifică modul în care are loc reacția. Fig. 2.1. Acesta arată că:
-Distribuitor energia totală dintre moleculele descrise curba clopot;
-katalizator scade energia de activare prin schimbarea modului în care are loc reacția, fără a afecta totală modificarea energiei libere;
un nod corespunde unui stat barieră de tranziție a energiei;
-cu formarea enzimatică produsului cataliză precede formarea complexului (complexul ES-)-enzimă substrat, care printr-o stare de tranziție este transformată într-un produs de enzime complexe (EP-complex), după care produsul este eliberat.
În general, ecuația cataliză enzimatică este scris ca:
4. Enzimele difera de catalizatori nebiologice următoarele proprietăți:
- eficiență ridicată a acțiunii - rata reacțiilor enzimatice, de obicei, 10 6 până la 10 de 12 ori mai mare decât reacțiile non-enzimatice corespunzătoare;
- o mare specificitate de acțiune - abilitatea de a alege un substrat specific și catalizează reacțiile specifice. Enzima este caracterizat ca o specificitate de substrat și specificitate mare a căii de transformare. Datorită acțiunii enzimelor în reacția celulară nu sunt dezordonată, nu încurcate și formează un cai metabolice strict definite;
- condiții blânde enzimatice de reacție: temperatura de 37 ° C, presiune atmosferică normală, un pH aproape neutru. In contrast, pentru cataliză chimică eficientă necesită adesea temperaturi și presiuni ridicate și pH extreme;
- capacitatea de a reglementa. Catalizator NOSTA activ multe enzime pot varia în funcție de concentrația substanțelor, controlează mai mult în funcție de concentrația substraturilor lor. Posibilitatea de reglare a activității enzimelor ei un fel de organizatorii proceselor metabolice din celula face.
Fig. 2.1. Profilul energetic al reacției.
Exemplul 2 Enzima reacție catalază accelerează dezintegrarea de peroxid de hidrogen la 10 de 12 ori.
Energia de activare pentru disocierea peroxid de hidrogen la oxigen și apă (H2O2-> H2O + 1 / 2O2) este de 18 kcal / mol, platina fină scade la 12 kcal / mol, reacția de accelerare 6 ordine de mărime.
enzima catalaza reduce energia de activare de 5,6 kcal / mol, care accelerează reacția cu 12 ordine de mărime.
5. izozimică - o formă a enzimei care catalizează aceeași reacție, dar diferă în unele proprietăți: secvența de aminoacizi, greutatea moleculară, amino compoziție acidă, compoziția subunităților, specificitatea de substrat, mobilitatea electroforetică, etc.
Izoenzime sunt produse de exprimare a diferitelor gene: genele pot fi pe cromozomi diferite (de exemplu, pentru amilazei salivare și amilazei pancreatice) sau un singur cromozom (de exemplu, pentru malatde dehidrogenază citoplasmatice și mitocondriale).
Există diferențe în distribuția izofer-mentelor în diferite țesuturi în diferite compartimente intracelulare care reflectă diferențele în metabolismul, de exemplu izoenzime pot avea afinitate diferită pentru substratul (glucokinazei Ficatul are o afinitate mai scăzută pentru glucoză decât hexokinază - izoenzima, care accelerează fosforilarea glucozei alte țesuturi).
Diferența în proprietățile izoenzimelor reflectă rolurile lor diferite, în diferite țesuturi, la diferite stadii de dezvoltare sau în diferite compartimente intracelulare.
Unul dintre mecanismele de bază ale izoenzimelor include combinarea diferitelor subunități în diferite combinații în formarea enzimei oligomeric active.
Exemplul 3. izozimică creatinei kinazei (CK) sunt formate prin combinarea a două subunități în molecula di-dimensional.
creatin kinazei catalizează reacția reversibilă a formării și dezintegrarea creatinei - o substanță care este implicată în stocarea energiei.
creatinkinazei
Creatina + ATP-<----------- ►Креатинфосфат + ADP
CK enzimă este un dimer format din două subunități. Subunitate B (creier) și M (mușchi) sunt codificate în gene diferite.
QC enzimă este reprezentat de 3 izoenzime care diferă în mobilitatea electroforetică:
VV (CC-1) - creier, avansarea maximă spre anod;
-MB (KK-2) - inima, mobilitatea medie;
- MM (CK-3) - musculare, cel mai lent.
Set izoforme CK în diferite țesuturi variază:
-KK-1 este prezentă în cantități semnificative în creier, prostată, stomac, plămân, placenta, glanda tiroidă.
-KK-2 se găsește în principal în mușchiul cardiac (25-46% din activitatea enzimei totală în cardiomiocite) în mușchii scheletici (5%).
KK-3 este prezent în principal în celulele mușchiului scheletic și cardiac.
Cele mai populare:
Tratamentul bolilor de sex feminin Tratamentul nbspnbspnbspnbspnbspnbspnbspnbsp imbinarilor nbspnbspnbspnbspnbspnbspnbspnbsp DENTAR TRATAMENT