Schema structurii atomice
Toată lumea știe că atomul este format dintr-un nucleu încărcat pozitiv, care este concentrată aproape toată masa. In interiorul nucleele sunt protoni și neutroni și în jurul acestuia în orbite muta electroni încărcați negativ (Fig. 1).
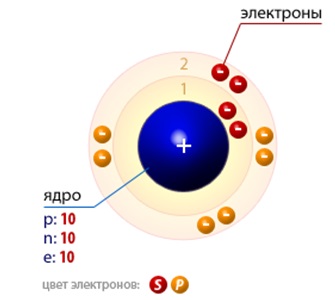
Fig. 1. Reprezentarea schematică a structurii atomului neon.
Modelul structurii atomice a fost propus în 1903 de George. George. Thomson. Conform ipotezelor sale atom constă dintr-o sarcină pozitivă este distribuit uniform în întregul volum de atomi si electroni oscilant in cadrul acestei sarcini.
Thomson ipoteză a fost testată și verificată de E. Rutherford, care a efectuat o serie de experimente pe dispersia alfa-particule cu plăci metalice subțiri și raportate. Pe baza cercetărilor sale, el a ajuns la concluzia că aproape toată masa unui atom este concentrată într-un volum foarte mic - nucleul încărcat pozitiv. În jurul miezului, la o distanță suficient de mare de electroni muta, iar numărul lor este astfel încât atomul global este electric neutru. Dimensiunile nucleului este foarte mic în comparație cu dimensiunea unui atom în ansamblu: diametrul atomului - de ordinul a 10 -8 cm, iar diametrul miezului - aproximativ 10 -13 - 10 -12 cm Un astfel de model structurii atomice numite nucleare ..
Cu toate acestea, în ciuda unui progres major în studiul structurii teoriei lui Ernest Rutherford atom nu a putut oferi un răspuns la două întrebări: stabilitatea atom și să conducă la concluzii greșite cu privire la natura spectrelor atomice.
O contribuție semnificativă la dezvoltarea ideilor despre structura atomului în 1913 a făcut Niels Bohr, care a propus teoria cuantică, unificarea modelului nuclear al atomului cu teoria cuantică a luminii. El a arătat că abilitatea corpului încălzit la radiația poate fi descrisă cantitativ presupunând că energia radiantă este emisă și absorbită în corpurile nu continuu, ci discret, adică porțiilor individuale - cuante.
Principalele prevederi ale teoriei sistemului structurii atomice a lui Bohr
Principalele prevederi ale teoriei, Bohr a declarat ca postulate:
- Un electron se poate roti în jurul nucleului nu este pentru oricine, ci numai pentru anumite orbite circulare specifice (staționare).
- Mutarea de-a lungul o orbită staționară, electronul nu radiază energie electromagnetică.
- Radiation are loc atunci când o tranziție bruscă a unui electron de la o orbită staționară în alta. Astfel emise sau absorbite de fotoni de radiații electromagnetice, a căror energie este egală cu diferența în energia finală a atomului și stările inițiale.
Dar teoria lui Bohr suferit de incoerență, cum ar fi ea nu a putut răspunde la întrebarea unde electronul se află în proces de tranziție de la o orbită la alta.
Această problemă a fost rezolvată numai după dezvoltarea unei noi ramuri a fizicii teoretice - cuantice (unda) mecanica (învățăturile Lui de Broglie și Schrödinger).
Exemple de rezolvare a problemelor
Greutatea atomică relativă a tungsten este egal cu 183,2. Este cunoscut faptul că tungsten este compus din doi izotopi: 183 W și 184 W. Se calculează fracția molară a fiecărui izotop din tungsten natural.
Izotopi - atomii aceluiași element chimic, cu număr de masă diferite (același număr de protoni, dar diferiți - neutroni). Să presupunem pentru x număr de atomi de wolfram al izotopului 183 W în fiecare sută atomi de tungsten naturali, atunci numărul de atomi ai izotopului 184 W va fi egal cu (100-x). Masa izotop 183 atomi W este egal cu 183h și 184 W - 184 x (100-x). Formează ecuația:
183h + 184 x (100-x) = 183,2 x 100%.
183h + 18400-18,320 = 184h;