Elementele din tabelul periodic al elementelor chimice
Inițial, elementele din tabelul periodic al elementelor chimice DI Mendeleev au fost aranjate în funcție de greutatea lor atomice și proprietățile chimice, dar de fapt dovedit că un rol crucial nu masa atomică, iar încărcătura de bază și, în consecință, numărul de electroni din atom neutru.
Starea cea mai stabilă a unui electron dintr-un atom al unui element chimic corespunde la minimum a energiei sale, precum și orice altă condiție numită electron excitat în ea poate migra spontan la nivelul de energie mai mic.
Luați în considerare modul în care electronii sunt distribuite în orbitalii atom, adică configurația electronică a unui atomi mulți electroni în starea de sol. Pentru construirea configurația electronică a următoarelor principii sunt umplute orbitali de electroni:
- principiul (interdicție) Pauli - într-un atom nu poate fi doi electroni cu același set de 4 numere cuantice;
- principiul cel mai scăzut de energie (principiul Aufbau) - orbitali sunt umplute cu electroni în ordinea crescătoare a orbitali energetice (Figura 1.).
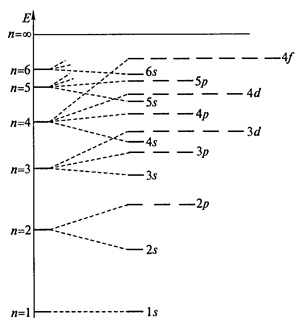
Fig. 1. orbitali de distribuție a unui atom de hidrogen din energie; n - numărul cuantic principal.
energia orbital depinde de suma (n + l). electronii orbitali sunt completate în ordinea sumei (n + l) ascendent pentru aceste ortitaley. Astfel, pentru subnivele 3d și suma 4s (n + l) va fi egal cu 5 și respectiv 4, în care primul care a fost umplut 4s orbital. Dacă suma (n + l) este aceeași pentru cele două orbitalii, orbitale este umplut mai întâi cu o valoare mai mică de n. Astfel, pentru suma 3d și 4p orbitali (n + l) va fi egal cu 5 pentru fiecare orbital, dar mai întâi umplut 3d orbital. În conformitate cu aceste reguli, ordinea orbitali de umplere este după cum urmează:
membru al familiei este determinat de electronii orbitali ocupate în ultimul rând, în conformitate cu energia. Cu toate acestea, nu puteți scrie formula e în conformitate cu energia acolo.
41 Nb 1s 2s 2 2 2 2p 6 3s 3p 4s 6 3d 10 4d 6 4p 2 3 2 5s corectă configurația electronică de înregistrare
41 2 Nb 1s 2s 2p 2 6 2 3s 4s 3p 6 3d 10 2 6 4p 5s 2 4d 3 configurație electronică invalidă
Pentru primele cinci d - elemente valent (adică, electronii responsabili pentru formarea legăturii chimice) reprezintă suma electronilor de pe d și s, electroni completat ultima. Pentru p - elementele valent reprezintă suma electronilor la s si p subnivele. Pentru e-valent elemente sunt electroni, situat la nivelul de energie externă s un substrat.
- regula lui Hund - o valoare de electroni l umple orbitale, astfel încât spinul total a fost maximă (figura 2).
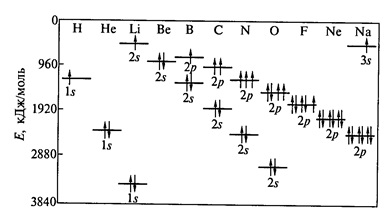
Fig. 2. Modificarea energiei la 1s -, 2s - 2p - orbitalii atomilor din două perioade a sistemului periodic.
Exemple de construcția atomilor configurații electronice
Exemple de construcția atomilor configurații electronice sunt date în tabelul 1.
Tabelul 1. Exemple de construire configurații atomi electronice