obligațiuni și delocalizate. localizate
Legătura covalentă poate fi localizată și delocalizată. conexiune de apel Localized, electronii care sunt împărțite între cei doi atomi de miezuri de legătură.
În cazul în care electronii de legătură sunt partajate între mai mult de două nuclee, vorbesc despre legăturile delocalizate. obligațiuni delocalizat - este o legătură covalentă, orbitalii moleculare care acoperă mai mult de doi atomi. Cel mai important factor care determină proprietățile chimice ale moleculelor, este distribuția densității electronilor în ea. Natura distribuției depinde de influența reciprocă a atomilor.
Împerecherea este disponibil în multe molecule organice ale compușilor (alcadienelor, hidrocarburi aromatice, acid carboxilic, uree, etc.). Sistemul de conjugare poate fi deschis sau închis și poate include nu numai atomi de carbon, dar și heteroatomi: Cl, O, N, S și colab (acroleină, acrilonitril, piridină).
Sistemul de interfață deschisă
De exemplu, o conexiune deschisă simplu cu sistem de conjugare care conține numai atomi de carbon este, de exemplu, 1,3-butadienă.
Toti cei patru atomi de carbon pe moleculă de 1,3-butadiena sunt în sp2 hibridizare. Toți acești atomi se află într-un plan și forma # 963; molecula -skelet. Figura 5.
p nehibridizate - orbitali fiecare atom de carbon situat perpendicular pe acest plan și paralele între ele. Acest lucru creează condițiile pentru suprapunerea reciprocă a acestora. Suprapunerea orbitali are loc nu numai între atomii de carbon C-1 și C-2 și C-3 și C-4, dar, de asemenea, parțial între atomii de carbon C-2 și C-3 (ris.5b). Când se suprapun patru orbitali pz sunt formate dintr-un singur nor π-electron, adică împerecherea două legături duble.
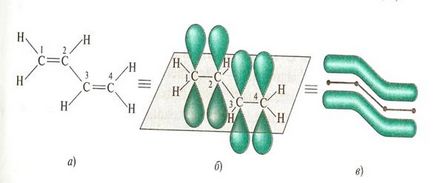
Acest tip de interfață se numește π, π-conjugare, adică. Pentru a interacționa orbitali tt-obligațiuni. Circuit de cuplare poate cuprinde un număr mare de legături duble. Cu cât este, mai delocalizare tt-electroni si mai stabil molecula. Sistemul π-conjugat de electroni nu este deja deținut de anumite conexiuni, adică acestea sunt delocalizate. E. sunt distribuite uniform pe întreaga moleculă. Delocalizarea tt-electroni din sistemul conjugat este însoțită de eliberarea de energie este numită energia de împerechere. Astfel de molecule sunt mai stabile decât sistemele cu legături duble izolate.
Motivul este că energia astfel de molecule de mai jos. Ca urmare a delocalizării electronilor în timpul formării sistemului conjugat este parțial lungimile legăturilor de aliniere: odinarnayastanovitsya mai scurte, și dublu-lung.
Hidrocarburile cu un număr mare de legături duble conjugate distribuite în lumea plantelor. Acestea includ, de exemplu, carotenoidele sunt responsabile pentru culoarea de morcovi, roșii, ulei, etc.
Al doilea tip sopryazheniya- p, π-conjugare. În p, sistemele tt conjugat formarea împerecherea participă atom cu un unshared de electroni pereche donor p. Acest lucru poate fi :. CI, O, N, S, etc. Acești compuși includ halogenuri, esteri, acetamidele, carbocationilor. Moleculele acestor compuși se realizează conjugarea dublei legături cu heteroatomii p orbital. Delocalizat legătura cu trei centru este format prin suprapunerea a două orbitali p -gibridizovannyh sp atom de carbon 2 și un p orbital cu perechi de electroni heteroatomi.
Toți atomii de carbon din molecula de benzen sunt în sp2 hibridizare. Six-sp hibrid formă nor benzen schelet.
toate # 963; -bond (C - C și C-H) se află într-un singur plan. Sase negidridizovannyh p-orbitali perpendicular pe planul moleculei sunt aranjate în paralel unul cu celălalt. Fiecare p-orbital se pot suprapune în mod egal cu cele două p-orbitali adiacente. Ca urmare a suprapunerii există un singur sistem π delocalizată, cea mai mare densitate de electroni, care este deasupra și dedesubtul planului # 963; -skeleta și acoperă toți atomii de carbon ai ciclului. Densitatea π-electron este distribuit uniform pe întregul sistem inelar. Toate legăturile dintre atomii de carbon sunt de lungime egală (0,139 nm), intermediar între lungimile legături simple și duble.
Compușii aromatici heterociclici are loc ambele tipuri sopryazheniyaπ, π-conjugare și p, π-conjugare.
π, π-Conjugare în compuși heterociclici aromatici tipic de heterocicluri cu șase membri. De exemplu, în piridină și pirimidină
Pirol Furan Tiofen
Aromaticitate - un termen care include o varietate de proprietăți ale compușilor aromatici, a introdus fizicianul german E. Hückel (1931).
O proprietate specială a anumitor substanțe chimice, în care legăturile nesaturate cu dublă inel prezintă stabilitate anomalously ridicată; mai mare decât cea care ar fi de așteptat doar sub o singură împerechere. Aromaticitate nu este direct legată de mirosul de compuși organici, și este un concept care descrie totalitatea proprietăților structurale și energetice ale unor molecule ciclice conținând un sistem de legături duble conjugate. Termenul „aromaticitatea“, a fost propus pentru că primii reprezentanți ai acestei clase de substanțe are un miros plăcut. Compuși aromatici sunt un grup mare de molecule și ioni de diferite clădiri care îndeplinesc criteriile de aromaticitate.
1. Plat buclă închisă.
2. Toate atomii C sunt sp2 - hibridizare
3. Conform cu regula Huckel: conține în inelul (4n + 2) p-electroni, unde n = 0,1,2,3 ...
4. Oferă un singur sistem conjugat, - sau p, tt-electroni.
5. Caracterizat prin substituție electrofilă reacție-SE.
6. Rezistent la agenți de oxidare.
7. Posedă stabilitate termodinamică.
Molecula unui compus organic este un agregat de atomi legați într-o anumită ordine legături covalente. Astfel, atomii legați pot varia în electronegativitate magnitudine (EO).
Electronegativitate - abilitatea unui atom de a atrage electroni densitate la un alt atom al unei legături chimice.
Cu cât valoarea EO acest element, cu atât mai mult atrage electroni de comunicare. Valoarea EO au fost stabilite de chimistul american L. Pauling și această serie se numește scara Pauling.
atom EO carbon depinde de starea de hibridizare sale ca atomi de carbon în diferitele tipuri de hibridizare sunt distinse una de cealaltă pe EO și acest lucru depinde de proporția de e-nor în formă de hibridizare. De exemplu, atomul C capabil sp 3 -hybridization are cel mai mic EO deoarece ponderea p-nor cade mai mici s-nori. Mai mult EO atom C are sp-hibridizare.
Toți atomii care constituie molecula sunt interconectate între ele și interferență experiență. Acest efect este trecut printr-o legătură covalentă cu efecte electronice.
Una dintre proprietățile legăturii covalente este o anumită mobilitate a densității de electroni. Ea este capabil să se deplaseze în direcția atomului cu o mai mare EO
Polaritatea legăturii covalente - este o distribuție neuniformă a densității de electroni între atomii legați.
Prezența unei legături polare în molecula afectează starea legăturilor adiacente. Ele sunt influențate de o legătură polară, iar densitatea de electroni este, de asemenea, trecerea spre mai EO atom ,. e., efectul de transfer de electroni.
Deplasarea densității de electroni de-a lungul lanțului # 963; -bonds numit efect inductiv și este notat I.
efect inductiv este transmis prin circuit cu amortizarea, adică. K. Formarea # 963; -bond, o cantitate mare de energie și este slab polarizată și, prin urmare, efectul inductiv este mai pronunțată pentru una, două legături. direcția de deplasare a densității de electroni # 963; -bonds denota săgeți drepte →;
E.O.atoma Cl> EO atomi de C
EO grupă hidroxil OH> EO atomi de C
Atomul sau grup de atomi, Polarizarea densitatea de electroni # 963; -bond de atomul de carbon la numit elektronoaktseptornymizamestitelyami și prezintă un efect inductiv negativ (-I- efect).
Ele sunt halogeni (CI, Br, I), OH -. NH2 -. COOH, COH, NO2. SO3H și colab.
Atomul sau grup de atomi, denumit donarea de densitate de electroni și donor de electroni substituenților prezintă un efect inductiv pozitiv (+ I- efect). + I-effektproyavlyayut radicali de hidrocarbură alifatică CH3. C2 H5 și colab.
efect inductiv se manifestă atunci când atomii de carbon asociate hibridizare ca fiind distincte. De exemplu, într-o propenă molecula CH2 = CH-CH3 CH3 exponatelor grup + I-efect, ca un atom de carbon în acesta este un sp3 -Hybrid de stat, și atomii de carbon la dubla legătură în sp 2 -Hybrid de stat și prezintă o electronegativitate mare, așa -I-show efect și sunt acceptori de electroni.
efect mezomeric
efect mezomerice. Spre deosebire de compușii neconjugate în care efectul electronic al substituenților pe transmise # 963; -bond (efect inductiv), în sisteme conjugate în impact electronic de transmisie a juca rolul principal al delocalizate tt-electroni ale legăturilor covalente. Efectul se manifestă printr-o schimbare a densității de electroni delocalizat (conjugat) apel l-sistem mezomeric (M-efect) sau efectul conjugare.
efect mezomerice - transferul influenței electronice substituenților asupra sistemului conjugat.
În același timp, deputatul însuși este un membru al sistemului conjugat. Se poate face interfața sistemului π-legătura (carbonil, carboxil și alte grupuri), o singură pereche de electroni heteroatom (halogen, amino și hidroxi), un vacant sau umplut cu unul sau doi electroni p-AO.
Substituenți care cresc densitatea de electroni în sistemul conjugat, prezintă un efect pozitiv mezomeric (M +)
+M -effect au substituenți conținând atomi având o pereche unshared de electroni sau cu o sarcină negativă. Acești substituenți sunt capabili de a transfera o pereche de electroni la sistemul conjugat global, adică. E. Sunt donor de electroni.
Substituenții care reduc densitatea de electroni în sistemul conjugat, prezintă un efect negativ mezomeric (-M).
(-M) -effect au substituenți care conțin legături duble și atomi încărcați pozitiv, m. E. substituenți acceptori de electroni.
Grăitor, deplasarea densității de electroni este indicată prin săgeți curbe, a căror început arată modul în care sunt deplasate p sau tt-electroni, iar la sfârșit - o legătură sau atomii la care sunt deplasate. Spre deosebire de inductiv, efectul mezomeric este transmis pe sistemul de obligațiuni conjugate o distanță mult mai mare.
Următoarele exemple arată manifestarea - efectul N- al grupării carbonil din benzaldehida și acroleina (π, π-conjugare),
și un efect + M al grupării amino din anilină (p, conjugare π-).
Tabelul 3 substituenți Efecte electronice
