1. Metanul pal arde cu flacără albăstruie, formând oxidul de carbon (IV) și apă;
2. O încălzire puternică fără metan aer este descompus în carbon și hidrogen
In cuptoarele de descompunere speciale de proiectare metan poate fi efectuată înainte ca produsul intermediar - acetilenă:
3. Pentru reacția de substituție tipic metan. De exemplu, lumina reacționează cu clor (în etape):
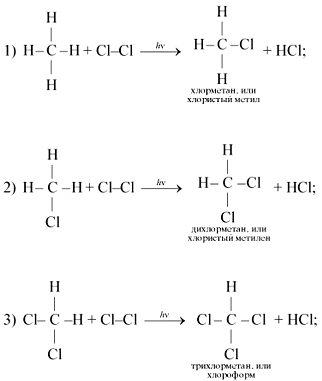
Educația metan halogenat curge prin mecanismul radical liber lanț.
4. metan la temperatura mediului ambiant are o rezistență ridicată la acizi, baze si multe oxidantii. Cu toate acestea, reacționează cu acid azotic diluat la o temperatură de 140 ° C și presiune scăzută (reacție radicală, reacția Konovalov):
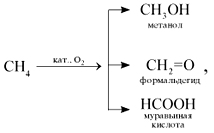
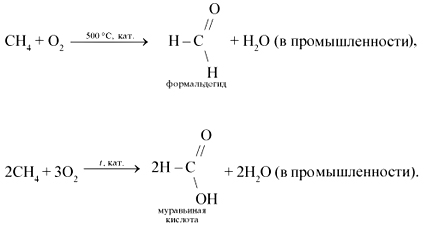
5. Când oxidarea metan moale cu oxigenul atmosferic în prezența diferiților catalizatori pot fi preparați prin metanol, formaldehidă, acid formic: