la lista de prelegeri
la lista de articole
Cea mai importantă producție chimică.
Analiza celor mai importante produse ale industriei chimice, justificarea alegerii condițiilor de reacție și tipurile de site-uri care sunt construite pe baza teoriei proceselor chimice și a teoriei reactorului. Prin natura produselor formate vizualizate producție sunt împărțite în două grupe: producția organică și anorganică, obiectele de studiu sunt producția de tonaj.
Tehnologia azotului legat.
Sub azot înțeleg azot legat, care este în formă compușii cu alte elemente - amoniac, acid azotic, uree, amine, aminoacizi, proteine, etc.
Azotul este unul dintre cele 4 elemente, care sunt indispensabile pentru existența materiei vii. Implicarea azotului în ciclurile geo- biochimice efectuate de aceasta în natura fixării atmosferei de către unele microorganisme din sol. Cu toate acestea, ea cantitatea de azot atmosferic fixat de aceste microorganisme, nu satisface nevoile civilizației moderne. În acest sens, azotul atmosferic în compusul său de transfer la scară industrială, este o sarcină practică globală, care are ca scop producerea de îngrășăminte cu azot supliment deficitul de azot legat în sol.
În prezent, metoda dominantă a procesului de fixare a azotului atmosferic este compus azot cu hidrogen pentru a produce amoniac.
Bazele teoretice ale sintezei amoniacului justifică selectarea parametrilor de proces.
Sinteza amoniacului are loc în conformitate cu o ecuatie stoichiometric
Această reacție este reversibilă, exotermă și este însoțită de o scădere a volumului. Reacția are loc pe catalizator - un fier poros suplimentat cu aditivi și promotori de stabilizare (Al2 O 3. K 2 O. CaO SiO 2, etc ...). Este activ și stabil termic în intervalul de temperatură 650-830 K. Compușii cu sulf otrăvesc catalizatorul ireversibil, iar o parte din oxigen și compușii săi, în special CO - reversibile, dar foarte repede, chiar în concentrații foarte mici.
Temperatura este un factor în viteză de reacție, dar cu creșterea temperaturii echilibrul de reacție se deplasează către reactanți. Acest lucru face ca prezența unei temperaturi de proces optim pentru un randament maxim. În practică, intervalul optim de temperatură este de 400-500 ° C, în funcție de combinația de alți parametri.
Presiunea este simultan și factorul de viteză și prejudecată factor de echilibru față de produsul de reacție. Deosebit de important este ultima funcție a presiunii, ca prin creșterea presiunii compensat efectul negativ al temperaturii ca factor în schimbare de echilibru față de materiile prime. Presiunea ridicată favorizează, de asemenea, condensarea amoniacului în etapele ulterioare. Presiune maxima este limitata de creșterea în comprimarea cheltuielilor și uzura accelerată. Contabilizarea efectele factorilor opuse determină alegerea optimă a presiunii. În practică, funcționează la presiuni de 30-32 MPa.
Raportul dintre reactanți sunt selectate pe baza cerințelor stoichiometriei și productivitate maximă, ceea ce corespunde exact raportul stoichiometric.
Viteza spațială este un factor crescând productivitatea reactorului, deoarece valoare. determinarea crește performanța - reducerea conversiei hranei în amoniac se suprapune peste rata de creștere în vrac W. Deoarece odată cu creșterea debitului volumetric al gazului crește cantitatea de gaze nereacționați trebuie reciclate, acest lucru duce la o creștere a consumului de energie pentru transportul gazelor, încălzirea acestora, răcire, creșterea dimensiunii conductelor și aparatul de reacție. Un alt obstacol major pentru creșterea vitezei de spațiu este contravenție modul autotermică datorită generării de căldură mai mici. În activitatea practică, cu valori optime W »40000 h -1, care corespunde gradului de conversie de azot din 27 - 28%.
viteze spațiale combinate pentru a satisface condițiile de temperatură optime, aplicarea amestecului azot-hidrogen cu puritate ridicată și utilizarea suficient de activă a masei de contact ar trebui să asigure o mai bună performanță pentru instalații industriale de sinteză a amoniacului la performanța economică ridicată.
Materii prime pentru sinteza amoniacului.
Deoarece amestecul inițial utilizat un amestec de azot-hidrogen în sinteza amoniacului. Hidrogenul se obține prin transformarea metanului
Ambele reacții au loc împreună cu o legare semnificativă a procesului de metan se realizează la temperaturi ridicate 1080-1100 K, oferind un echilibru practic de deplasare (2), în partea dreaptă. Procedeul se realizează într-un reactor tubular, prin spațiul cochilie care circulă gazele de ardere fierbinți formate în timpul arderii gazelor naturale în arzători flare dispuse în partea superioară a reactorului. În scopul accelerării procesului, pentru a forma hidrogen și legarea CO (otrava de contact) care iese gazul din reactor intră în etapa de conversie a 2 în reactorul de tip adiabatic. Aici, pentru a menține temperatura dorită în zona de reacție (1230 - 1280 K) în reactor este alimentat cu aer. Căldura necesară este acumulată prin arderea parțială a gazelor naturale.
Pe de altă parte, acesta din urmă reacția este o sursă de necesară pentru reacția (2) și (3) vapori de apă. La fel ca aerul din reactor cu azot, etapa 2 convertizor realizează atât funcția de separare a azotului din aer. Pentru a forma un amestec stoechiometric de H2. N2 = 3. Aerul 1 este alimentat cât de mult este necesar, stoichiometria procesului de sinteză a amoniacului.
gaz Convertit conținând CO2 (17 - 18% vol.) și CO (0,3 -. 0,5% in volum). Primul este amestecul balastat pentru sinteza amoniacului. Multiple azota amestec de recirculare conținând CO2 poate duce la o acumulare progresivă de CO2 în recirculată. Acest lucru va reduce viteza de reacție și deplasarea echilibrului (1) din stânga nedorite. A doua impuritate CO este otrava de catalizator. În acest sens, hidrogenul furnizat la sinteza, să fie purificată de CO2 și CO. Eliberată de absorbție a dioxidului de carbon 19 - soluție 21% din monoetanolamină (NH2 CH2 CH2 OH).
Absorbția este realizată la temperaturi scăzute pentru a asigura deplasarea echilibrului (5) în direcția produsului carbonizare. Absorbat rezultată este stripată la temperatură mai ridicată prin deplasarea echilibrului (5) la stânga. Rezultată CO2 pur este un produs comercial și poate fi utilizat ca reactant (sinteza ureei), agentul frigorific și un solvent pentru recuperarea componentelor valoroase din plante medicinale. Monoetanolamină după desorbție este reintrodusă în procesul de absorbție.
CO extrem de dificil de a extrage metode sorbției cantitative. Prin urmare, purificat de CO 2 este supus hidrogen metanare, conversia CO in metan inofensiv pentru proces. Monoetanolamină după curățare a gazului este preîncălzit și alimentat într-un reactor care conține un catalizator de nichel. Acesta este hidrogenat CO și CO2 balanțe.
Într-un multi-coloană (Fig. 1) este utilizat ca reacția principală a unității de sinteză a amoniacului. Coloana este înălțimea cilindrului de circa 30 m și un diametru de aproximativ 2,5 m, realizat din oțel special capabile să reziste la presiuni mari, temperaturi și efecte agresive de azot, hidrogen și amoniac. gaz rece este alimentat în partea inferioară a coloanei și este îndreptată în sus între mantaua coloanei (15) și corpul cutiei de catalizator (3). În partea superioară a gazului rece reactor intră în partea de carcasă a schimbătorului de căldură (6), în care acesta este încălzit la 400 ° C, prin căldura evacuată din reactor prin conductele schimbătorului de căldură cu gaz de sinteză. Amestecul încălzit azot-hidrogen trece succesiv cu patru straturi de catalizator (8, 10, 12 și 14) și intră în conducta centrală (2), pe care este trimis în schimbătorul de căldură (6). Atunci când acest gaz este răcit la aproximativ 330 ° C
Datorită faptului că reacția este exotermă gaz de sinteză a amoniacului la catalizatorul se încălzește pe rafturi. Când temperatura deviază semnificativ de optim. Pentru reglarea temperaturii se asigură un flux de alimentare cu by-pass de amestec azot-hidrogen rece prin tuburi (7, 9, 11 și 13), în fiecare pat de catalizator.
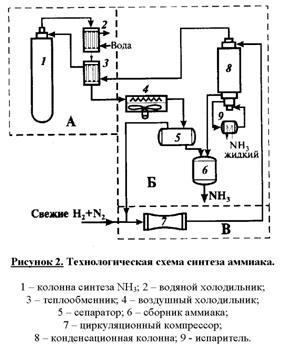
Gazul rece este apoi încălzit într-un schimbător de căldură (3) și reciclat în coloana de sinteză (1). Furnizarea de compresor de circulație a fluxului (7). Înainte de a-l în gazul de reacție circulant se adaugă un amestec de azot-hidrogen proaspăt.
Atunci când reciclarea multiplă a amestecului azot-hidrogen acumularea de substanțe inerte (Ar și CH4) în gazul de recirculare, astfel încât linia de recirculare a gazelor de aerisire furnizat (ieșire) o parte din gazul de recirculare. Aceste gaze pot fi utilizate drept combustibil sau agenți de reducere pentru împrăștiere. care conțin oxizi de azot.
Principalele direcții ale dezvoltării producției de amoniac.
1. Cooperarea industriei nitric cu industria de sinteză organică de bază bazată pe utilizarea gazelor naturale și gaze de rafinărie ca materie primă;
2. Consolidarea întregii producții în ansamblul său, și subsistemele sale individuale;
3. Dezvoltarea proceselor bazate pe un sisteme catalitice mai active, reducând astfel presiunea în proces;
4. coloane de sinteză Aplicație cu catalizator „pat fluidizat“;
5. Îmbunătățirea în continuare utilizarea rațională a sistemelor de recuperare a căldurii.
Puteți utiliza sistemul de putere tehnologie în producția de amoniac la această din urmă problema. Compression primul gaze naturale la etapa de conversie la 4,5 MPa, urmată de un amestec de azot-hidrogen la 30-32 MPa, circulația în sinteza este realizată folosind turbocompresoare subsistem puternic. În plus, sistemul de alimentare are un număr de linii. Consumul total de energie este 880-900 kW x h / m (NH3). Cheia este un amestec de azot-hidrogen compresor, la o viteză de aproximativ 11.000. / Min, consuma mai mult de jumătate din producția de energie totală de amoniac. Aplicația este aproape imposibil de a conduce motorul compresorului. Prin urmare, în acest scop, transportatorul de energie este utilizat - abur cu parametri înalți: presiune de până la 10 MPa și o temperatură de 720 - la 740 K. Pentru a conduce alte compresoare și turbine cu abur utilizate în energie cu mai puține parametri. În producția de amoniac utilizat fluxuri de mare potențial proces: gazul convertit și gazele de ardere după conversia metanului. Dar energia și capacitatea lor suficientă pentru a forma o pereche cu performanțe ridicate. Necesită sursă de energie de înaltă temperatură opțională. Ei cazan auxiliar este ars, montat în conductă după cuptorul tubular. Aburul produs în cazane, de recuperare a căldurii, fluxuri tehnologice în liniile, iar cazanul suplimentar este colectat într-un tambur de abur și de acolo este distribuit către turbina cu abur conduce la compresoare. astfel producția de amoniac devine autonom în perechea de energie, dar producția sa este utilizată pentru resursele energetice secundare, consumând cantitate suplimentară de combustibil - gaze naturale.
la lista de articole
la lista de prelegeri