Compuși metaloid hidrogen. Modele în schimbarea proprietăților lor datorită poziției elementelor chimice din tabelul periodic D. I. Mendeleeva.
Hidruri. În compușii nemetale cu hidrogen are o stare de oxidare +1. Deoarece energia de ionizare a hidrogenului este foarte mare, legătura sa chimică cu nemetale nu covalente ionice și polare. Elementele electronegative pe perioadele din partea dreaptă, cum ar fi sulful și clorul majoritatea P, reacționează cu hidrogen, formând hidruri covalente care au proprietăți acide și rezistența crește acide cu dimensiunea atomilor de hidrogen sunt atașați metaloid. Excepțiile sunt CH4 metan. care este un compus neutru și amoniac, NH3. având proprietăți de bază. Compușii cu hidrogen non-solubil în acizi și apă formează cu aceleași formule.
Mai multe elemente p electronegativ, de exemplu, aluminiu, siliciu și fosfor, într-o stare încălzită nu reacționează cu hidrogen.
Bilet №14.
Oxizii superioare ale elementelor chimice din a treia perioadă. Modele în schimbarea proprietăților lor datorită poziției elementelor chimice din tabelul periodic D. I. Mendeleeva. Proprietățile chimice caracteristice ale oxizilor: basic, amfoteric, acid.
Reactivitatea elementelor în interacțiunea cu oxigenul, în general, scade atunci când se deplasează spre dreapta de-a lungul fiecărei perioade. On-exemplu, în perioada 3 a doua s-metal, sodiu și magneziu, și două rânduri de elemente, aluminiu și fosfor, reacționează puternic cu oxigenul pentru a forma oxizi. În aceeași perioadă a elementelor siliciu și sulf sunt capabile să reacționeze lent cu oxigenul numai. Clor și argon este dispus la capătul din dreapta al perioadei, nu reacționează cu oxigenul.
metale-S electropozitiv formează oxizi ionici, cum ar fi oxidul de sodiu Na2 O, și oxid de magneziu MgO. Oxizii de elemente aranjate în perioada de mijloc și porțiunile drepte sunt predominant compuși covalente, cum ar fi oxizii de azot și sulf.
Oxizii de caractere acido-bazic, de asemenea, modificări de oxizii de bază ale elementelor din partea stângă a perioadei în oxizi amfoteri elemente în mijlocul perioadei și apoi la oxizii acizi ai elementelor din partea dreapta a perioadei. De exemplu, s-Metals formează în mod tipic oxizi, care sunt solubile în apă, pentru a forma o soluție alcalină:
Moleculare p-oxizi ai elementelor, cum ar fi dioxidul de carbon și trioxid de sulf, în mod obișnuit au proprietăți acide. variație periodică a proprietăților de bază ale tranziției la proprietățile acide evidente din oxizi ai elementelor din 3-a repriză.
Bilet №15.
Acizi, proprietățile lor de clasificare și chimice pe baza unor reprezentări ale disocierii electrolitice. Proprietăți Proprietăți de acid sulfuric concentrat în exemplul de interacțiune cu cupru.
Acid - substanță complexă, care se formează în disocierea doar un singur tip de cation - ioni de hidrogen.
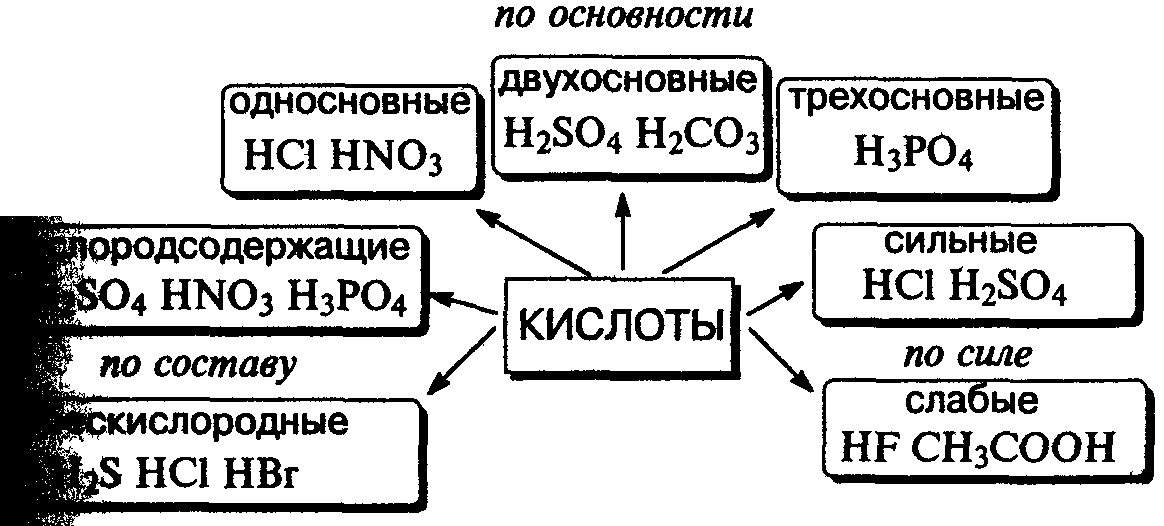
Acid clorhidric - clor soluție de gaz de apă de hidrogen în apă.
Proprietăți chimice. Acid modifica indicatorii de culoare: turnesol devine roșu, metil oranj - galben.
După reacția cu bazele sării formate și apă (reacție de neutralizare). Reacția ia de bază atât solubile, cât și substanțe insolubile în apă:
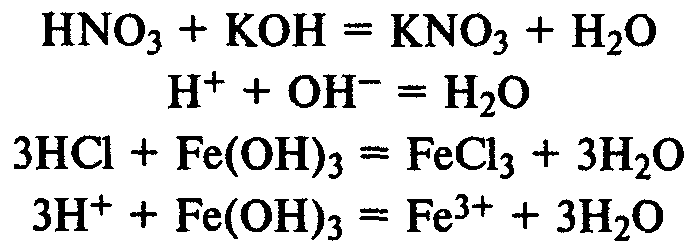
După reacția cu oxizi de bază formate cu dacă:
Acizii reacționează cu metalele din seria electrochimică a hidrogenului, se formează gazul eliberat și sarea în formă de hidrogen:
Acizii tari reacționează cu săruri de slabe ki-fantă deplasând acidul slab dintr-o sare a acestuia:
Acizi de preparare. Mulți acizi pot fi semi-acide prin oxizi Chit reacția cu apă:
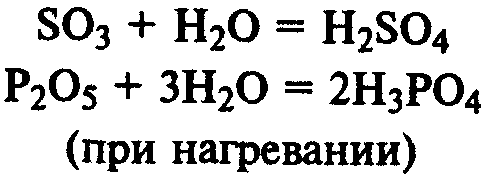
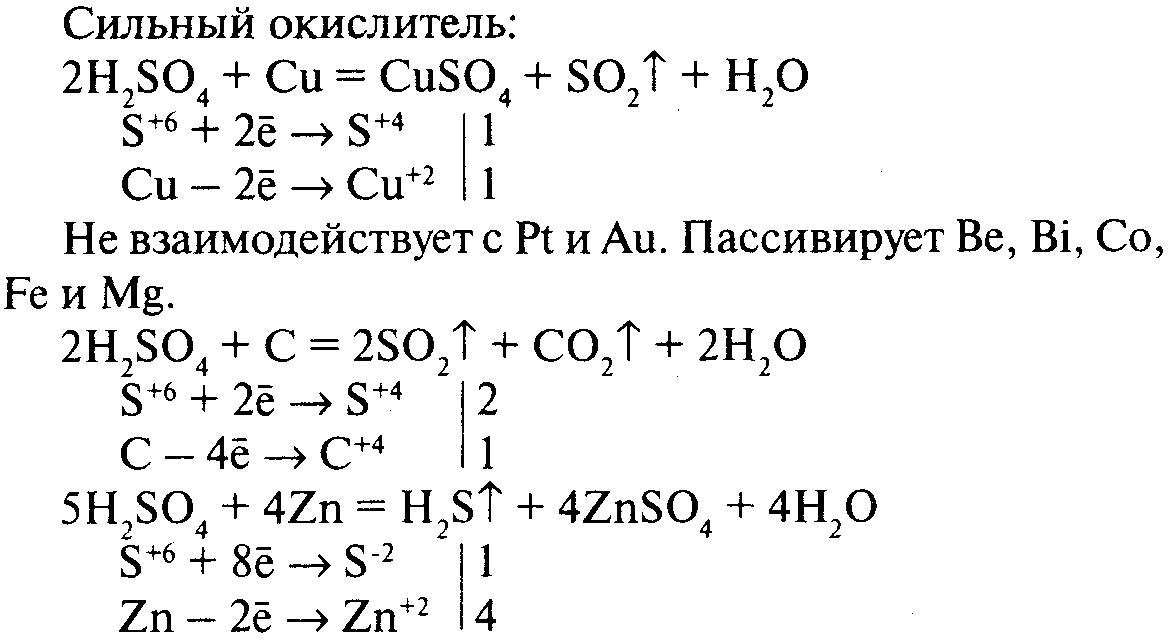
Acid sulfuric concentrat, la temperatura ambiantă, nu are efect asupra multor metale. Din acest motiv, de exemplu, fără sulfuric și acid apos, spre deosebire de soluțiile sale pot nyatsya-conservă într-un container de fier.
Cu toate acestea, actele de acid sulfuric concentrat pe aproape toate metalele prin încălzire. În această formă de sare sulfuric KIS loturi, dar nu hidrogen este eliberat, iar substanța obținută alte Insulele, de exemplu dioxid de sulf.
Astfel, prin încălzire cu acid sulfuric inițial cupru acid sulfuric concentrat oxidează cupru la oxid de cupru, și în sine este redus, astfel, la acidul sulfuros, care se descompune imediat dioxidul de sulf și apă:
Oxidul de cupru care rezultă este reacționat cu exces sulfuric KIS loturi, formând o sare și apă;
Astfel, oxidul de cupru este un intermediar substanță TION în această reacție. Adăugarea acestor ecuații, obținem ecuația Ito trăgând-reacție, care include numai sursa și co-finite Materie: