Definiția și sare comestibilă formula
Sare alimentare (sodiu) - sarea de sodiu este acid clorhidric. În condiții obișnuite reprezintă cristale albe (Fig. 1), slabogigroskopichnye, dar este proprietatile lor a crescut dramatic în prezența impurităților naturale, cum ar fi săruri de magneziu
Topituri și fierbe fără descompunere. Moderat solubil în apă (non-hidrolizată), solubilitatea nu depinde de temperatură, dar este mult redusă în prezența HCl, NaOH, cloruri metalice. Dizolvat în amoniac lichid. Ea prezintă deficiențe de reducere proprietăți.

Fig. 1. sare comună. Aspect.
Sare comestibilă Formulă chimică
Formula chimică sare comestibilă NaCl. Acesta arată că compoziția moleculei includ un atom de sodiu (Ar = 23 uam) și un atom de clor (Ar = 35,5 amu). Conform formulei chimice poate fi calculată greutatea moleculară a sării comestibile:
Dl (NaCl) = Ar (Na) + Ar (CI);
Dl (NaCl) = 35.5 + 23 = 58.5
Grafic sare comestibilă (structural) formula
sare comestibilă Structură (grafică) formulă este mai intuitiv. Acesta arată modul în care atomii sunt conectate unul la celălalt în moleculă:
formula ionica
Clorura de sodiu - este sarea acidului clorhidric mediu capabil de a disocia în ioni în soluție apoasă conform următoarei ecuații:
NaCI ↔ Na + + Cl -
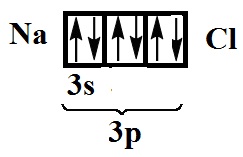
formula E
moleculă Educația sare comestibilă are loc prin formarea unei perechi de electroni totală și electronii nepereche de clorură de sodiu (unul de la fiecare atom):
Exemple de rezolvare a problemelor
In timpul arderii 7 g substanță organică obținută 11,2 l (STP) CO2 și 9 g de H2O Densitatea relativă a substanței de oxigen este 1.313. Găsiți formula moleculară a substanței.
reacția de ardere cartografiată compușilor organici având desemnat numărul de atomi de carbon, hidrogen și oxigen pentru «x», «y» și «z», respectiv:
Se determină masa elementelor care alcătuiesc substanța. Valorile maselor atomice relative luate din Tabelul Periodic D. Mendeleev, rotunjită la întregi: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Se calculează masa molară a dioxidului de carbon și apă. După cum se cunoaște, masa molară a moleculei este suma maselor relative atomice ale atomilor din molecula (M = Mr):
M (CO2) = Ar (C) + 2 x Ar (O) = 12+ 2 x = 12 + 16 32 = 44 g / mol;
M (H2O) = 2 x Ar (H) + Ar (O) = 2 x 16 = 1 + 2 + 16 = 18 g / mol
m (C) = [11,2 / 22,4] x 6 = 44 g;
m (H) = [2 x 9/18] × 1 = 1 g
Definim ca un compus chimic cu formula Cx Hy:
x: y = m (C) / Ar (C). m (H) / Ar (H);
De aici mai simplu compus cu formula CH2 și masa molară de 14 g / mol [M (CH2) = Ar (C) + 2 x Ar (H) = 12 x 2 + 1 = 14 g / mol].
masa molara a materiei organice poate fi determinată prin densitatea sa în ceea ce privește oxigenul:
Msubstance = 32 x 1,313 = 42 g / mol
Pentru a găsi formula adevărată găsi raportul compus organic obținut masa molară:
Msubstance / M (CH2) = 42/14 = 3
Prin urmare, indicii de atomi de carbon și hidrogen ar trebui să fie de trei ori mai mare, adică substanțe formula va avea forma C3 H6.