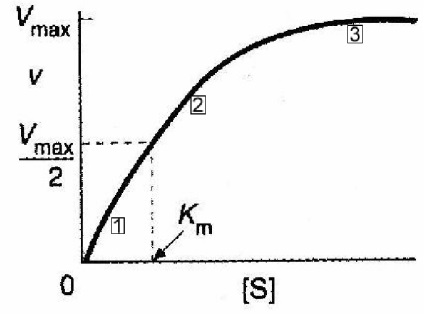
Figura 2-6. Un grafic viteza V a concentrației substratului de reacție [s] La concentrații scăzute ale substratului (în [s] <0.1 Км, обозначено (1), рис 2-6), можно показать что
.. R e al ecuației Michaelis-Menten rezultă că v = k [S]; Viteza de reacție este direct proporțională cu concentrația substratului. Aceasta - reacția primului ordin. Astfel de cinetici sugerează că enzima nu este saturată cu substrat și unele enzime sunt libere. Prin urmare, adăugarea de mai substrat, conduce la formarea unor cantități mai mari de ES complexe enzimă substrat, care este putrefacție, oferă o mai mare produs de reacție P.
La concentrații ridicate de substrat (dacă este [S]> Km 10, indicată de 3, Fig 2-6)
Aceasta înseamnă că viteza de reacție a devenit independentă de concentrația substratului. (Reacție de ordinul zero), iar acest lucru poate fi explicat prin faptul că toate moleculele enzimatice sunt saturate cu substrat. Adăugarea de cantități mai mari de substrat în soluție nu crește ES și, prin urmare, viteza nu este schimbat.
Dependența între zonele 1 și 3 din grafic este amestecat.
Din cele de mai sus rezultă o altă concluzie importantă dacă concentrația substratului este între 0,1 km și 10 km, enzimele sunt utilizate în mod eficient, fără pierderea controlului asupra părții substratului. În cadrul acestui interval, modificări ale concentrațiilor de substrat sunt reflectate în modificările ratei de reacție.
Care este znachenieKm fizică? ecuația Michaelis-Menten poate fi convertit la acest tip de
Din această ecuație este ușor să arătăm că
Ie, Km = [S], în cazul în care viteza de reacție este jumătate din viteza maximă și, prin urmare, este exprimată în unități de concentrație. Presupunând că k3 < Valoarea Km oferă de asemenea o idee despre eficiența relativă a cataliza și de reglementare. Când [S] >> 10 km, reacția este eficientă ( „de lucru“, toate moleculele enzimatice), dar reacția își pierde capacitatea de a regla cantitatea de substrat. Când [S] <<0.1 Km, эффективность реакции низка, но имеется хорошее управление скоростью реакции путем изменения концентрации субстрата. Наиболее удобное сочетание эффективности и контроля соблюдается при условии, если концентрация субстрата одного порядка со значениями Km. Эти выводы имеют важное прикладное значение. Если Вы отлаживаете исследование фермента или в клинической лаборатории или исследовательской лаборатории, следует насыщать фермент субстратом. Знание Км позволит Вам оценивать концентрацию субстрата, необходимую для гарантии насыщения. Эта концентрация должна быть равна по крайней мере двум Км. В физиологических условиях, для эффективной работы концентрация субстрата должна быть на уровне Км этого фермента, но если важно управление концентрацией субстрата, концентрация субстрата должна быть в диапазоне ниже 5 Км. Practic se calculează valoarea Km și Vmax, utilizând curba descrisă de ecuația complexului Michaelis și Menten. Sa dovedit a fi mai convenabil să se definească acești parametri în coordonatele „valorile duble inverse.“ Michaelis formula ecuație în acest caz, ia forma și dependența - o linie dreaptă (Figura Lineweaver-Burk).
Figura 2-7. Un grafic al vitezei de reacție față de concentrația substratului. Method "duble" (de reciproce Lineweaver-Burk grafic).
O astfel de metodă permite exprimarea calcul mai exact valorile Km și V. Linia de intersecție cu axa 1 / [S] valoare permite calcularea Km, și intersecția cu axa 1 / V - viteza maximă.
Michaelis Menten ecuație și permite calcularea eficienței enzimei
Viteza Kcatili. Așa cum sa arătat mai sus, viteza maximă pentru toate reacțiile catalizate de enzime, se realizează la plin substrat enzimatic saturație, apoi [ES] = [Et] și
Din acest motiv, K3 (care este, de asemenea, numit kcat la saturație completă a substratului) este considerată ca fiind numărul de rotații, și
Valoarea ridicată maximă a kcat / KM, care este determinată de frecvența de coliziune a substratului și a enzimei va depinde de viteza de difuzie a reactanților în soluție. Acest tip de reacție se numește răspunsuri restricționate difuzie. Cu condiția ca fiecare coliziune duce la formarea teoriei difuziei complex enzimatic substrat prezice că limita superioară a kcat / KM. ca o manifestare a reacției mai mare perfecțiune enzimatică poate atinge valori de ordinul 10 august - 10 9 (mol / l) -1 sec -1. Substratul nu poate fi mutat la enzima mai repede. Astfel de enzime, cum ar fi karbangidraza, fumarase și triozofosfat se apropie de fapt, această limită. Viteza lor catalitică este limitată numai de viteza cu care se ciocnesc cu substratul în soluție. Orice creștere suplimentară a vitezei poate fi realizată numai în cazul în care reducerea timpului de difuzie. Intr-adevar, multe dintre enzimele într-o celulă legată de ansambluri organizate în care produsul unei enzime este rapid dupa enzima. De fapt, produsul trece de la o enzimă la o altă linie transportor similar.
Mai jos sunt o serie de valori Km, Kcat și kcat / km, ceea ce va permite să prezinte intervale de aceste valori.
Valorile Km, raportul kcat și kcat / Km sunt prezentate în Tabelul 2-3.
Tabelul 2-3. Valorile Km, raportul dintre kcat și kcat / Km pentru diferitele enzime.
Kcat / Km (M / L) -1 sec -1
Etil N-atsetilGli
Etil N-atsetilVal
Etil N-atsetilTir
Pentru a continua descărcarea aveți nevoie pentru a asambla o imagine: