Valence. electroni Hybrid (hibridizează) orbital. lungimea de obligațiuni
Caracteristicile legăturilor chimice în eniyah conectat bioorganica ??
SISTEMUL RELATED: aciclici și ciclici.
1. Caracteristicile legăturilor chimice în bioorganica conectate eniyah ??. orbitali hibridare de atomi de carbon.
2. Clasificarea sistemelor conjugate: aciclici și ciclici.
3 Tipuri de conjugare. π. pi și π. r
4. Criterii de stabilitate sisteme conjugate - „“ sopryazheniya energie „“
5. aciclic (non-ciclice) sisteme conjugate, tipuri de conjugare. reprezentanți majori (alcadienelor, acizi carboxilici nesaturați, vitamina A, caroten, licopen).
6. Sistemele ciclice conjugate. Criterii de aromaticitate. regula Huckel. Rolul π-π-. π- # 961; -conjugacy în formarea sistemelor aromatice.
7.Karbotsiklicheskie aromatic cuplat ?? Eniya: (benzen, naftalină, antracen, fenantren, fenol, anilină, acid benzoic) - structura, formarea unui sistem aromatic.
8. heterociclic aromatic de legătură ?? Forma Supunerea (piridină, pirimidină, pirol, purina, imidazol, furan, tiofen) - structura, în special formarea unui sistem aromatic. Hibridizarea orbitali electroni ai atomului de azot în formarea de cinci - și heteroaromatic cu șase atomi care leagă ?? eny.
9. importanta biomedicale conectarea naturale ?? eny conținând sistem de legătură conjugat, și hidrocarburi aromatice.
Nivelul inițial de cunoștințe pentru a stăpâni teme (curs chimie școală):
Elemente electronice de configurare (carbon, oxigen, azot, hidrogen, sulf. Halogeni) „“ concept „orbital“, hibridizarea orbitală și orientarea spațială a perioadei elementele orbitale 2. tipuri de legături chimice, în special covalente # 963; s π -bonds, elemente de schimbare electronegativitate în perioada și grupul. Principii de clasificare și terminologia organice de conectare eny ??.
molecule organice formate prin legături covalente. Legăturile covalente au loc între cele două miezuri din cauza totalul atomilor perechii (socializata) electroni. Această metodă se referă la mecanismul de schimb. Formată legături nepolare și polare.
bond nonpolar se caracterizează prin densitate de electroni distribuite simetric ?? HAND între cei doi atomi, care leagă această relație.
legături polare caracterizate nesimetric (inegală) partiționat ?? densitate HAND electroni are loc în direcția deplasării sale atom mai electronegativ.
Rânduri electronegativitate (trase în jos)
A) Celule: F> O> N> C1> Br> I
B) un atom de carbon: C (sp)> C (sp 2)> C (sp 3)
Legăturile covalente sunt de două tipuri: sigma ( # 963;) și pi (π).
Moleculele organice Sigma (# 963;) obligațiuni sunt formate din electroni, dispus pe hibridul (hibridizate) orbitali, densitatea de electroni este situată între atomii de pe linia imaginară care leagă ele.
π -bond (pi -bond) apar atunci când suprapunerea a două orbitali non-hibridizat p. Principalele axele lor sunt paralele între ele și perpendiculare linii # 963; -bond. combinație # 963; --svyazey și π se numește dublu (multiple) legătură cuprinde două perechi de electroni. O triplă legătură este format din trei perechi de una elektronov- # 963; - și doi π -bond (în bioorganica conectat ?? eniyah extrem de rare) ..
# 963; -bond implicat în formarea skel ?? molecule ETA, ele sunt majore. și π -bond pot fi considerate suplimentare, dar conferi proprietăți speciale chimice ale moleculelor.
1.2. hibridizarea Orbital la 6 atomi de carbon
configurație neexcitat electroni stare de atom de carbon
exprimate partiționat ?? HAND electron 1s 2s 2 2 2p 2.
In bio ?? eniyah conectate, precum și, în cele mai multe substanțe anorganice, atomul de carbon are o valență egal cu patru.
Există o schimbare a unuia dintre 2s de electroni la un drum liber 2p orbital. Există stări excitate ale atomului de carbon, care creează posibilitatea formării de hibrid a trei stări, notate C C sp 3. sp 2. Cu sp.
Hybrid orbital are caracteristici diferite „p s,, orbitali d- și este“ from''chistyh „“ „“ smesyu două sau mai multe tipuri de orbitali non-hibridizat.
orbitali hibride sunt specifice numai atomilor în molecule.
Conceptul de hibridizare introdus în 1931 L.Polingom. câștigătorul Premiului Nobel ?? evskoy,.
Luați în considerare poziția în spațiu a orbitali hibride.
C s p 3 - ↑ - - ↑ - - ↑ - - ↑ -
In stare de excitare format 4 orbitali hibride echivalente. obligațiuni locație corespunde direcției unghiului central al unui tetraedru regulat, valoarea unghiului dintre oricare două legături este egal cu 109 0 28.
Alcanii și derivații acestora (alcooli, haloalcani, aminele) Sun e ?? atomi de carbon, oxigen, azot sunt în același sp3 Condiția hibrid. atom de carbon formează patru atom trei azot, un atom de oxigen, doi covalente # 963; -bond. În jurul acestor relații liber părți rotative ale moleculei în raport unul cu altul.
In starea excitată are loc trei orbitali sp 2 hibrizi sunt echivalente, aranjate pe electronii formează trei # 963; -bond. care sunt situate într-un plan, unghiul dintre link-uri 120 0. nehibridizate 2p - orbitalii doi atomi de wc ?? ednih formă π-obligațiuni. Este perpendicular pe planul în care sunt # 963; -bond. Interacțiunea p electroni este, în acest caz, denumirea „“ partea „perekryvaniya“. legătură multiplă nu permite rotația liberă în jurul său fragmente. Poziția fixă de părți ale moleculei însoțită de formarea a două forme izomere geometrice plane, care sunt numite. cis (cis) - și trans (trans) - izomeri. (Cis-Latină - pe de o parte, trans- lat - prin).
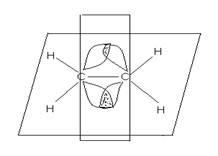
Atomii atașat printr-o legătură dublă, sunt sp starea 2 hibridizare și
prezent în alchenilul aromatic ?? eniyah formă legată o grupare carbonil
> C = O, grupa azometine (grupa imino), -CH = N-
C sp 2 - - ↑ - - ↑ - - ↑ -
Formula structurală a organică de legătură ?? Eniya reprezentate folosind structuri Lewis (fiecare pereche de electroni între atomii se înlocuiește cu o liniuță)
1.3. Polarizarea de legături covalente
Legătură covalentă polară se caracterizează printr-o densitate de electroni HAND neuniform distribuite ??. Pentru a indica direcția de deplasare a densității de electroni utilizând două imagini convenționale.
polar # 963; - comunicare. Deplasarea densității de electroni indicată de o săgeată de-a lungul legăturii. Sfârșitul săgeata îndreptată către atomul mai electronegativ. Apariția sarcinilor pozitive și negative parțiale punct de o litera b „“ „„Delta“„““ cu semnul corect al taxei.
b + b-b + b + b-b-b +
aminometan metanol clormetan (metilamină)
Polar π-obligațiuni. Deplasarea densității de electroni indică o (curbat) săgeata semicircular deasupra legăturii pi este de asemenea direcționată către atomul mai electronegativ. ()
1. Se determină tipul de hibridizare a atomilor de carbon ai oxigenului. azot conectat ?? eniyah A, B, C. Apel conectat ?? Eniya. utilizând regulile de nomenclatura IUPAC.
2. Faceti o notație care caracterizează direcția de polarizare a soarelui ?? ex aceste legături în conectarea ?? eniyah (A - D)