1. legea lui Maxwell de distribuție a moleculelor cu o viteză gaz ideal și energie.
2. Gazul ideal într-un câmp gravitațional uniform.
formula barometrică. distribuție Boltzmann.
3. Numărul mediu de coliziuni și calea medie liberă a moleculelor.
4. Fenomene de transport în Gaze.
1. legea lui Maxwell de distribuție a moleculelor
viteza gazului ideală și energie
Gazul într-o stare de echilibru, o distribuție staționară a vitezelor moleculare, supunându legea lui Maxwell.
Clausius
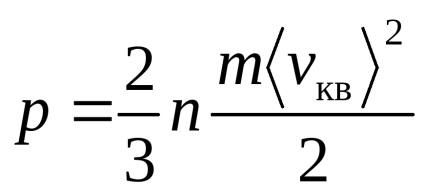
Ecuația Mendeleev - Clapeyron
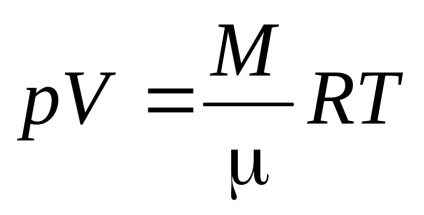

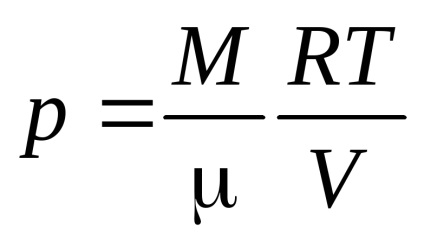
și anume medie a vitezei pătrat este proporțională cu rădăcina pătrată a temperaturii absolute a gazului.
legea lui Maxwell descrisă de (v) funcția f, nazyvaemoyfunktsiey a distribuției vitezei. Dacă împărțit gama de viteze moleculare la mici intervale egale dv. apoi pentru fiecare interval de viteză va reprezenta un număr de molecule dN (v), cu o rată închisă în ea. Funcția f (v) determină numărul relativ de molecule dN (v) / N, vitezele sunt în intervalul de otv Dov + dv. și anume
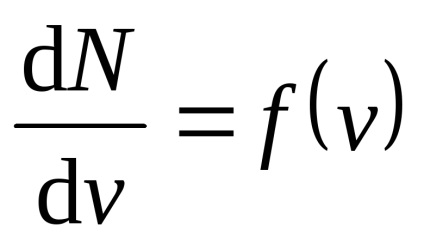
Aplicând metodele teoriei probabilitatilor, Maxwell a găsit o funcție f (v) este legea pentru distribuirea moleculelor cu o viteză ideală de gaz:
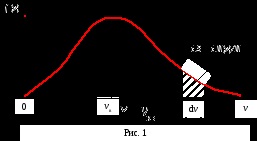
Numărul relativ de molecule dN (v) / N. vitezele sunt în intervalul de otv Dov + dv. Acesta este modul în care să se dezbrace un dS zona. Aria de sub curba distribuției și axa x este egal cu unu. Aceasta înseamnă că funcția f (v) satisface condiția de normalizare
Skorostyuvv rata cea mai probabilă numit în apropierea care vitezele interval unitate au cel mai mare număr de molecule.
Viteza medie a moleculei

Valoarea medie a vitezei pătrat (8)
Din (6) rezultă că la temperaturi mai mari maximul distribuției moleculelor funcției vitezei dreapta CME-schaetsya (viteză valoare-Yat-clorhidric mai probabil devine mai mare). Cu toate acestea PLO - Schad delimitată de curba rămâne neschimbată, astfel încât la ridicarea curbei de temperatură a distribuției vitezei moleculelor și coborâte întinse.
De-a lungul axei cilindrului interior cu diferența calibrat de sârmă de platină, stratul tăiat lea de argint, în care curentul de încălzire etsya-va la aerul evacuat. Când argint-Gre-Vania se evaporă. atomi de argint zboară afară prin fanta să cadă pe suprafața interioară a doua Tsilina-core, oferind imaginea cu fantă. Dacă bor-set în mișcare de rotație în jurul unei axe comune cilindru, atomii de argint nu se rezolva împotriva diferenței și sunt deplasate cu o anumită distanță. Imagine slit obținută neclară. Investigarea grosimii stratului depus, este posibil să se estimeze distribuția vitezei care corespunde maxwelliana Ras pre-diviziune.
2. Gazul ideal într-un câmp gravitațional uniform. formula barometrică. distribuție Boltzmann
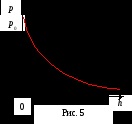
Dacă nu ar exista mișcare termică, toate moleculele de aer ar cădea la pământ; dacă nu ar exista gravitație, aerul ar fi dispersat în tot universul. Gravitatea și mișcări termice cauza gazelor într-o stare în care concentrația acestuia și de scădere a presiunii cu înălțimea.
Obținem modificări ale presiunii legale cu altitudinea.
Diferența de presiune p ip + dp este greutatea gazului închis în zona de bază cilindru ecran egală cu unitatea și DH înălțime
p - (p + dp) = g dh

Din legea gazului ideal:
unde p ir0 - vysotahh presiunii gazului și h = 0.
Formula (12) se numește barometru cal. Din aceasta rezultă că presiunea scade cu altitudinea exponențial.
Formula barometrică permite determinarea înălțimii h cu ajutorul unui barometru. Barometru, special calibrați, pentru înălțimea de referință directă deasupra nivelului mării nazyvayutaltimetrom. Acesta este utilizat pe scară largă în aviație, în timp ce urca pe munte.
Generalizarea formula barometric
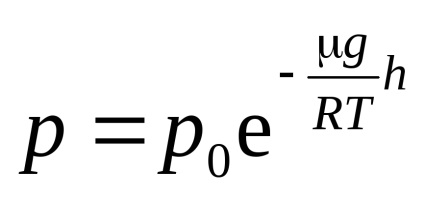

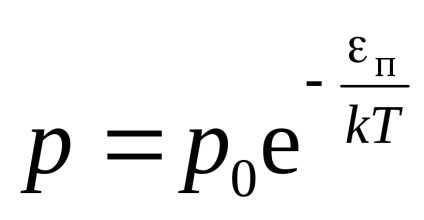

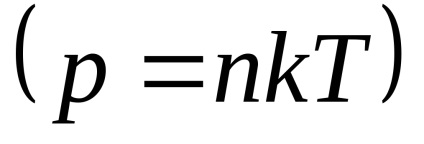

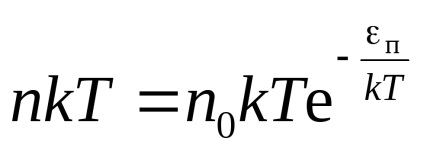

in0 unde n - concentrația moleculară în vysotahh 0 și h =, respectiv 0.
1.
2.
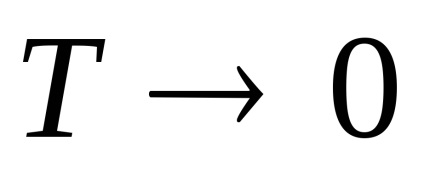
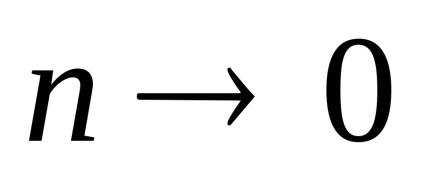
3. Numărul mediu de coliziuni și calea medie liberă a moleculelor
Calea medie liberă a moleculelor

Diametrul efectiv al molekulyd numit cea mai mică distanță pe care punctele convergente într-o coliziune a două molecule.
secțiune molecule eficiente
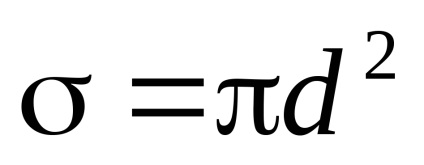
Viteza medie a mișcării moleculare

face socoteală




mișcarea celuilalt coeficientului moleculelor considerate
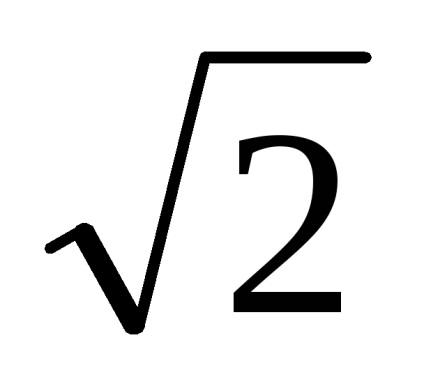
Substituind (7.30) în (7.28), obținem lungimea medie liberă calea
condiție de gaz, în care
