În prezent, chimia organică considerată ca chimia compușilor de carbon, dar care plătesc tribut povești încă mai continuă să facă referire la ea în chimia organică. Prin urmare, este important să se ia în considerare mai în detaliu structura elementului atomului, natura și direcția spațială au format legături chimice.
atom de carbon este format dintr-un miez având o sarcină pozitivă de 6 (deoarece conține șase protoni), iar învelișul de electroni, pe care există șase electroni dispuse la două nivele de energie (straturi):
Structura actuală a atomilor de carbon este mult mai complicată decât reprezentată în diagramă.
Faptul că „viu“ în spațiul electronului în jurul nucleului are atât proprietăți și a particulelor (o masă de 1/1840 din masa protonului sau neutronului) și lungimea de undă (capabil de a ocoli obstacolele - difracție, caracterizat printr-o amplitudine oarecare, lungime de undă, frecvența de oscilație și t. d.). Este imposibil să se determine cu precizie poziția electronilor în jurul nucleului. De aceea vorbește de o probabilitate mai mare sau mai mică de a găsi un electron într-o anumită regiune a spațiului. Dacă am putea lua o imagine a unui atom și poziția de imagine a electronului ar fi reflectate în formă de puncte, apoi aplicarea unui număr mare de imagini ne-ar obține o imagine a norului de electroni. Cea mai mare densitatea norului, cu atât mai probabil electronul se află în această zonă. Spatiul din jurul nucleului, care se află 90% din norul de electroni, numit orbital. Aceasta înseamnă că 90% din timp, un electron este în acest spațiu închis. În viitor, vom înțelege termenul „orbital“ și „nor“, ca fiind echivalente.
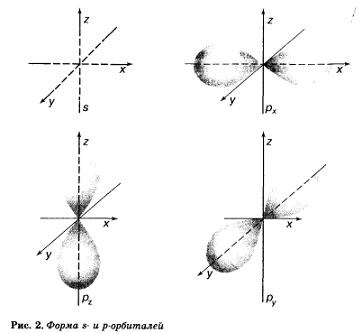
atom de carbon are două tipuri de orbitali I Orbitali formă sferică și p-Orbitali sub formă de haltere sau vrac opt (figura 2.).
Aceste orbitali sunt diferite unele de altele, nu numai în formă, ci și îndepărtarea nucleului atomului. Cu cât este mai îndepărtat de nucleul orbital, mai multă energie are orbitali de electroni pe acest lucru. Energia de electroni - cea mai importantă caracteristică a stării sale. Mai mult decât atât, și foarte important, energia unui electron dintr-un atom poate accepta numai anumite valori, iar electronul orbital poate ocupa o anumita distanta de nucleu. Aceste orbitali diferă în marjă (nivel) de energie.
Pentru a distinge între nivelurile de energie, acestea sunt numerotate în ordinea distanta de la nucleu. Cel mai aproape de miezul - primul (1), atunci a doua (2), etc ...
Nivelul de carbon al primei un I-orbită palanul în care există doi electroni. Cel de al doilea atom de carbon la nivel de energie conține, de asemenea, s orbital, dar mai mare, ca alimentarea cu energie a electronilor pe acesta este mai mare decât primul nivel de electroni și trei orbitali p. Acest dumbbell orbitali de aceeași dimensiune, care sunt reciproc perpendiculare, ca axele de coordonate x, y și 2 (a se vedea. Fig. 2). Fiecare orbital poate conține doi electroni, dar cu valori de spin opuse.
Spin (din limba engleză pentru a spin -. Rotire) - este intrinsec momentul magnetic al electronului (introducerea conceptului de „spin-“, în 1925 a sugerat că proprietățile magnetice ale electronilor ca particulele încărcate cauzate de o rotație în jurul propriei sale axe). Spinul electronului apare numai în timpul interacțiunii cu alți electroni și câmpul magnetic exterior. Spin poate avea doar două valori - pozitive și negative.
Pentru a prezenta localizarea electronilor în atomul, trebuie să ne amintim că fiecare electron ocupă poziția cea mai favorabilă energetic, la care furnizarea de energie va fi mai mic. El se străduiește întotdeauna să ia cel mai aproape de miezul situației și de a lua pe formă mai simplă orbitale (de exemplu, în primul rând pe S-, și numai apoi, în p-orbital). Dacă în termen de un nivel există mai multe identice orbite-palane, electroni plasate inițial pe fiecare orbital separat cu aceeași rotire, și doar apoi în perechi, dar cu spin opus. Prin urmare, formula E atomul de carbon va avea forma 1s 2s 2 2 2p 2.
Foarte des, structura cochilii de electroni ale atomilor afișate prin formulele de difracție de electroni. Fiecare orbital este notat cu o singură celulă; fiecare electron - de săgeată; direcția săgeții corespunde direcției de rotire.
El descrie formule grafice de electroni de atomi de carbon și hidrogen.
Valența elementului chimic este cel mai adesea determinat de numărul de electroni nepereche. atom de carbon, așa cum se vede din formula de difracție de electroni, are doi electroni nepereche, astfel încât participarea lor pot forma două perechi de electroni, care transportă două legături covalente. Totuși, compușii organici de carbon nu sunt doi, ci întotdeauna tetravalent. Acest lucru poate fi explicat prin faptul că, în excitat (pentru a obține energie suplimentară) atom vine abur 2 „electroni și trecerea de la unul la 2p orbital:
Un astfel de atom are patru electroni nepereche și pot participa la crearea patru legături covalente.
Pentru a forma legături covalente necesare pentru un atom de suprapunere orbital-op bital cu cealaltă. Cu cât se suprapun, cu atât mai puternică conexiunea.
Formarea H2 legătură covalentă moleculei de hidrogen se produce datorită suprapunerii s-orbitali (Fig. 3).
Distanța dintre nucleele atomilor de hidrogen sau o lungime legătură de 7,4 * 10 -2 nm, în timp ce puterea - 435 kJ / mol.
Pentru comparație: în moleculă un atom de fluor F2 legătură covalentă este formată prin suprapunerea a două orbitali p.
Lungimea legăturii Fluoro-fluor este egal cu 10 -2 • 14,2 nm și rezistența (energie) conexiune - 154 kJ / mol.
Legăturile chimice formate ca urmare a suprapunerii orbitalilor de electroni de-a lungul liniei de comunicație, numită o legătură (legături sigma).
linie de comunicație - linia care leagă nucleele atomilor. Pentru în orbitali se pot suprapune doar singura cale - pentru a forma un obligațiuni.
p orbitali se pot suprapune pentru a forma un legături și poate, de asemenea, se suprapun în cele două domenii, formând o legătură covalentă la o altă specie - datorită suprapunerii „lateral“:
Legăturile chimice formate ca urmare a „parte“ a orbitalii de electroni se suprapun în afara liniei de comunicare, adică. E. În două zone, numite p-obligatiuni (obligațiuni pi).
Tipul Considerat de caracteristică de comunicare a moleculelor C2H4 de etilenă, acetilenă, C2H2. Dar mai multe despre acest lucru, vei învăța următorul paragraf.
1. Se înregistrează formula atomi de carbon electronic. Explicați semnificația fiecărui caracter în ea.
Care sunt formula electronică de bor, beriliu și litiu?
Asigurați-vă de electroni formule grafice atomilor acestor elemente corespunzătoare.
2. Scrieți formula electronică:
a) un atom de sodiu și un cation Na +;
b) cationi de magneziu Mg 2+ atomi;
c) un atom de fluor, iar anion F -;
d) un atom de oxigen și O 2- anion;
d) ionii de hidrogen, H + și un atom de H -.
Asigurați-electron orbitalii formule grafice ale distribuției electronilor în aceste particule.
3. Atomul elementului chimic corespunde cu formula E 1s 2 2s 2 2p 6?
Care cationi și anioni au aceeași formulă de e-? Asigurați formula electronică grafică a atomului și a acestor ioni.
4. Comparați lungimea legăturilor în moleculele de hidrogen și fluor. Care a cauzat diferența?
5. moleculele de azot diatomice și fluor. Comparați numărul și natura legăturilor chimice dintre atomii din ele.
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.