Marea majoritate a proteinelor are proprietăți hidrofile, adică capacitatea de a interacționa cu ușurință cu moleculele de apă. Proteinele hidrofiliei datorate grupurilor polare încărcate și neîncărcate polare situate pe suprafața moleculelor lor. Polar încărcat grupuri din molecula de proteină sunt radicalii de lizină, histidină, arginină, acid aspartic și acid glutamic; neîncărcați polar - radicali serină, treonină, tirozină, cisteină, asparagină, glutamină, etc. substanțe hidrofile se dizolvă ușor în apă și soluții apoase ..
Solubilitatea în solvenți proteine variază și depinde de mai mulți factori, inclusiv natura, compoziția și pH-ul tăriei solventului, ionică și temperatura soluției, caracteristicile structurale ale moleculei de proteină, și de alți factori. Ca urmare, unele proteine sunt foarte solubile în apă, altele - în soluții apoase de săruri neutre, și altele - în soluții diluate de acizi sau baze, al patrulea - într-un amestec de apă și solvenți organici (de exemplu, etanol sau acetonă). În solvenți organici mai pure nu se dizolva proteinele. Dintre proteinele, sunt insolubile în toți acești solvenți. Acest lucru se datorează o caracteristică a structurii lor.
O valoare mare pentru solubilitatea soluției de proteină are o tărie ionică (în particular, concentrația electrolitului). La punctele forte ionice mici, proteine crește solubilitatea, și la ridicat - este redusă. Dependența rastvrimosti cele mai multe proteine pH-ul la o tărie ionică dată este descrisă de U curba cu o solubilitate în formă minimă în apropierea punctului izoelectric și solubilitate crescută la valori de pH mai jos și deasupra punctului izoelectric. Odată cu creșterea temperaturii la o anumită valoare (de exemplu, 0 până la 25 la - 40 ° C) crește solubilitatea majorității proteinelor (această regulă are o excepție).
Când dizolvarea proteinelor în apă și soluții apoase, are loc hidratarea fiecare moleculă de proteină, adică reacția dintre grupările polare ale proteinei cu apă. În acest exemplu, grupările -CO-NH- leagă o moleculă de apă, grupările carboxil - patru molecule de apă, o grupare amino - pe o singură moleculă de apă.
In hidratarea in jurul moleculelor de proteine încărcate formate strat (înveliș) hidrat apos elektrozaryazhennosti constând din molecule de apă orientate în raport cu molecula de proteină într-un anumit fel.
Continuare a moleculelor de apă îndepărtată de pe suprafața moleculei de proteină, aranjamentul dezordonat al lor în soluție. In jurul moleculelor de proteine electroneutral se formează coajă hidrat.
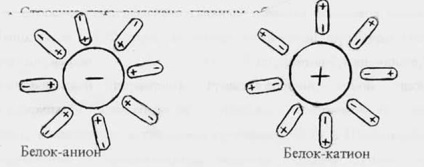
coajă de proteine hidratată previne agregarea particulelor și, astfel, promovează soluție de proteină ustoychivsti. Astfel, încărcați și coajă de hidratare sunt factori importanți în stabilitatea soluțiilor proteice.
În timpul precipitării proteinelor este necesară pentru a elimina factorii care cauzează stabilitatea soluțiilor lor, adică distruge învelișul de hidratare și de a elimina sarcina electrică.
Distruge coajă de hidratare poate fi prin adăugarea la soluția de proteină în cantități suficient de mari de d a t de m și n și w u și x (deshidratare), substanțe cum ar fi etanolul, acetona, sulfat de amoniu, o sare neutră.
precipitarea proteinei din soluție prin adăugarea de săruri neutre și sulfat de amoniu menționate cu s și l și n e și m.
Alte proteine sărare cu concentrații inegale de săruri neutre. Această proprietate este larg utilizat pentru a separa un amestec de proteine.
sarcina electrica poate fi îndepărtată prin adăugarea de acid într-o soluție de proteină sau un alcalin la un pH egal cu punctul izoelectric al proteinei dizolvate. După cum sa arătat mai sus punctul izoelectric nu electrostatic între repulsie moleculele de proteină și acestea sunt ușor să precipite. Deoarece proteine diferite au diferite puncte izoelectrice, ele pot fi separate prin precipitare la punctul izoelectric.
Precipitarea mai completă a proteinei poate fi realizată prin distrugerea învelișului de hidratare și îndepărtarea sarcinii electrice.