§4 Act Maxwell de distribuție a vitezei și a energiei
Legea de distribuție a gazelor ideale molecule viteza este, teoretic, obținută prin Maxwell în 1860 definește, la un număr de molecule dN omogene (p = const) gaz monohidroxilici ideal de numărul total N de molecule sale pe unitatea de volum este la o anumită temperatură T viteza în intervalul de la v și v + dv.
Pentru a obține funcția de distribuție a vitezei moleculare f (v) egală cu raportul dintre molecule Dn. vitezele sunt în intervalul de v ÷ molecule v + dv la numărul total N și valoarea intervalului dv
Maxwell a folosit două propuneri:
a) toate direcțiile în spațiu sunt egale și, prin urmare, orice direcție de mișcare a particulelor, adică, orice direcție de viteză este la fel de probabil. Această proprietate este uneori numit proprietatea funcției de distribuție izotrop.
b) deplasarea de-a lungul a trei axe perpendiculare între ele, care sunt independente x-componentă a vitezei nu depinde de ce valori sau componente ale acestora. Și apoi de ieșire f (v) este o premieră pentru o singură componentă. și apoi generalizat la toate coordonate de viteză.
Se crede de asemenea că gazul este format dintr-un număr mare de molecule N identice într-o stare de mișcare termică aleatoare la aceeași temperatură. Forcefields de gaz nu funcționează.
Funcții f (v) determină numărul relativ de molecule dN (v) / rata N din care se situează în intervalul de la v la v + dv (de exemplu, gaz are molecule N = 10 iunie în care dN = 100
moleculele au o viteză de v = 100 v + dv = 101 m / s (dv = 1 m) în acel moment.
Folosind metodele teoriei probabilitatilor, Maxwell a găsit o funcție f (v) - legea distribuției a moleculelor cu o viteză ideală de gaz:
f (v) depinde de tipul de gaz (în greutate a moleculei) și cantitatea de stat (temperatura T)
f (v) depinde de raportul dintre energia cinetică a moleculei care corespunde valorii vitezei considerate kT caracterizează energia termică medie a moleculelor de gaz.
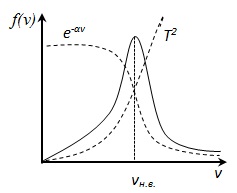
. prin urmare, temperatura crește rata crește mai probabile, dar aria de sub funcția curbei de distribuție S. rămâne neschimbată, deoarece condiția de normalizare (deoarece probabilitatea unui anumit eveniment este egal cu 1), astfel încât la ridicarea curbei de distribuție a temperaturii f (v) se va întinde sau descrește .
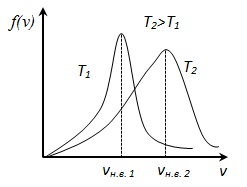
Apoi aritmetică a vitezei moleculelor
și integrarea de piese
stare de gaz caracteristică Viteză
§5 Verificarea experimentală a legii de distribuție Maxwell - experiența Stern
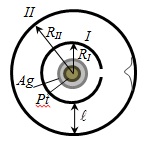
Imagine slit obținută neclară. Investigarea grosimii stratului precipitat poate fi estimată distribuția vitezei, ceea ce corespunde unei distribuții maxwelliana.
§6 Formula barometrică
Cu toate acestea luate în considerare comportamentul gaz ideal, nu este afectată de câmpuri de forță externe. Din experiență, este bine cunoscut faptul că acțiunea forțelor externe, o distribuție uniformă a particulelor în spațiu poate fi rupt. Astfel, sub acțiunea moleculelor de gravitație tind să se scufunde pe fundul vasului. mișcare termică Intensive previne sedimentarea și molecule distribuite astfel încât concentrația lor scade treptat odată cu creșterea înălțimii.
Derive o variație a presiunii de drept cu înălțimea presupunând că câmpul gravitațional este uniform, temperatura este constantă și masa tuturor moleculelor identice. Dacă presiunea atmosferică la înălțimea h este egal cu p. apoi la înălțimea h + DH este egal cu p + dp (cu dh> 0, dp <0, так как p уменьшается с увеличением h ).
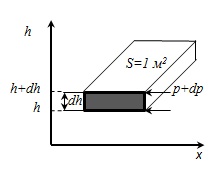
densitate la înălțimea h. și din moment ce. it = const.
Din ecuația Mendeleev-Clapeyron.
Propotentsiruem expresia (
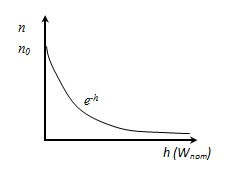
Formula barometrică, arată modul în care presiunea variază cu altitudinea
.
n densitatea moleculelor la o înălțime h,
0 n densitatea moleculelor la înălțimea h = 0.
energia potențială a moleculelor într-un câmp gravitațional
distribuția Boltzmann într-un potențial câmp extern. Din aceasta rezultă că, dacă T = densitatea gazului Const mai mare în cazul în care mai mică decât energia potențială a moleculelor.
§7 Determinarea experimentală a constantei Avogadro
J. Perrin (om de știință francez), 1909 a fost studiat comportamentul particulelor browniene în emulsie Gamboge (seva de copac), cu dimensiuni au fost examinate cu un microscop, care a avut o adâncime de câmp - 1 mm. Mutarea microscopul într-o direcție verticală a fost posibilă investigarea distribuției ajustării particulelor browniană.
Aplicarea pentru a le distribuția Boltzmann poate fi scris
n = - unde m este masa unei particule
m - masa fluidului deplasat:
Dacă n 1 și n 2 concentrația particulelor la nivelurile h 1 și h și 2. k = R / NA.
Valoarea este în bună concordanță cu valoarea de referință care confirmă distribuția Boltzmann a particulelor