Electrolitii sunt substanțe care se descompune în ioni în soluție și, prin urmare, conductiv electric. Ras electroliți pad în ioni când dizolvați în apă, apelurile lor Xia de disociere electrolitica. Sub acțiunea unuia curent-elektriches ionilor de mișcare direcționată dobândesc: ioni pozitivi încărcat negativ-muta spre catod și sunt numite Catty-one (
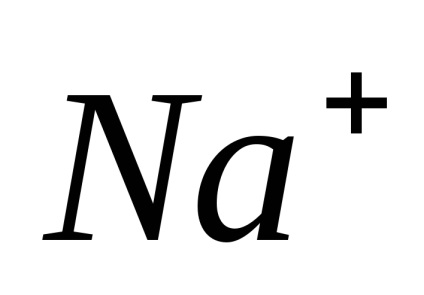
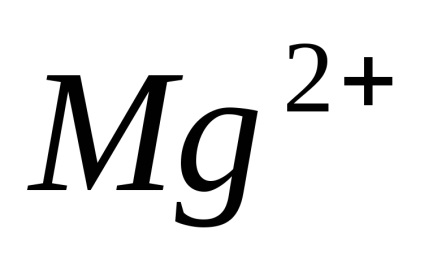
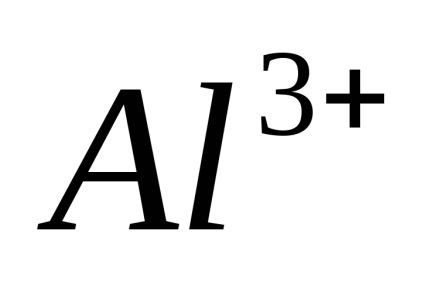
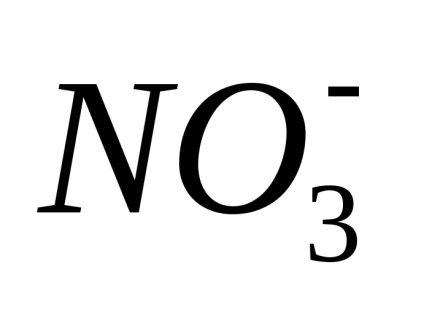
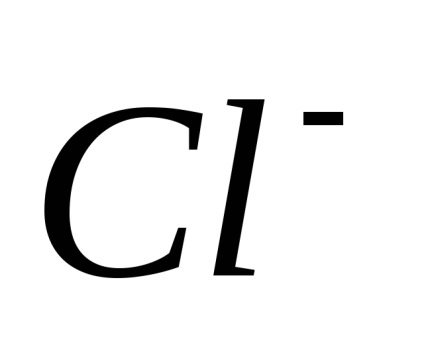
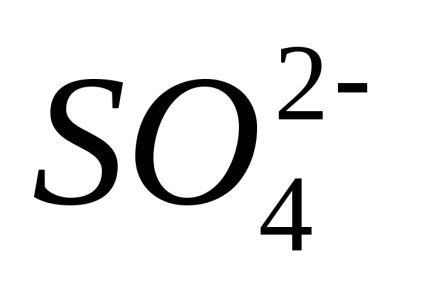
Disocierea - un proces reversibil, adică, în paralel cu descompunerea moleculelor proces are loc ioni compus în ioni (disociere) (asociație). De aceea, în ecuațiile de disociere electron-troliticheskoy în loc de semnul egal pus semnul reversibilitate.
Substanțele care nu se descompun în soluție în ioni și nu conduce curentul electric, numit non-electroliți (petrol, benzina, kerosen, ulei combustibil, alcool, soluție de zahăr etc.).
În funcție de gradul de disociere distinge electroliți puternici și slabi. Valorile gradului de disociere a anumitor electroliți sunt prezentate în tabelul. 3 aplicatii. gradul de disociere

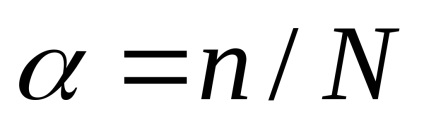
Gradul de disociere este determinată empiric prin plumb rang electrolit conductivitate și este exprimată în fracțiuni de unități sau ca procent. De exemplu, dacă



În funcție de gradul de disociere a tuturor elec-trolity sunt împărțite în puternice (



PH, sau pH-ului soluției.
Apa chimic pură este un electrolit slab și o foarte mică parte din moleculele sale disociază în ioni:
Conform legii acțiunii masei constanta de echilibru a apei se determină concomitent și exprimarea constantă de disociere niem:
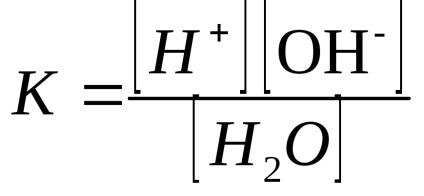
Pentru o temperatură de 25 ° C, constanta de disociere a apei este de aproximativ
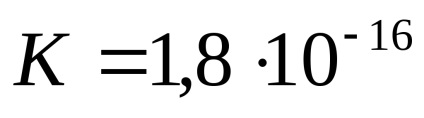
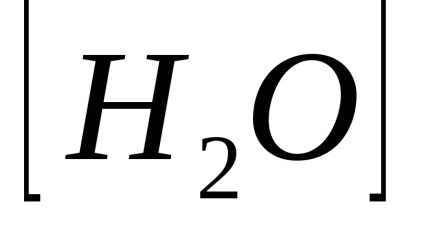
Apă și soluțiile diluate ale produsului din concentrația ionilor de hidrogen și anioni de hidroxid este o cauza constantă a produsului ion-plumb numit de apă
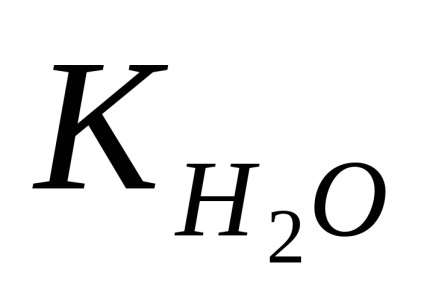
În apă pură și soluții neutre se află la 25 ° C:
În soluții acide peste concentrația ionilor de hidrogen și în alcaline -
concentrația de anioni de hidroxid; produs
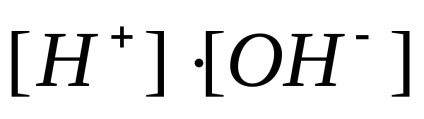
proprietăți acide și bazice ale electroliților obicei caracterizate prin cantitatea de concentrație de ioni de hidrogen. Pentru a evita utilizarea exponenților negative care concentrația menționată este exprimată, este exprimat în mod obișnuit indicele de hidrogen străpungere, simbolul notat pH. Indexul de hidrogen - logaritm con-centrarea ionilor de hidrogen, luate cu semnul opus:
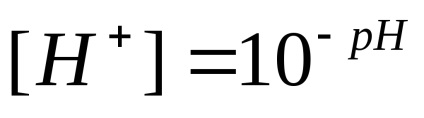
Cu pHharakter mediu poate fi reprezentat după cum urmează:
pH = 7 - mediu neutru; pH <7 – кислая среда; рН> 7 - mediu alcalin.
indicatori utilizați pentru a determina mediul de reacție. Indicatori - sunt reactivi speciali care își schimbă culoarea în funcție de concentrația de ioni de hidrogen. Pro-mezhutok între cele două valori ale pH-ului, care variază în culoarea indicatorului, denumit culoarea de tranziție interval indicatorului. Folosind estimarea aproximativă a pH-ului soluției poate da un universal in-catori. O valoare mai precisă a pH-ului se determină cu ajutorul unui dispozitiv de pH-metru.
PH-ul este unul caracteristici importante ive medii corozive și depinde de conținutul gazelor dizolvate în apă:
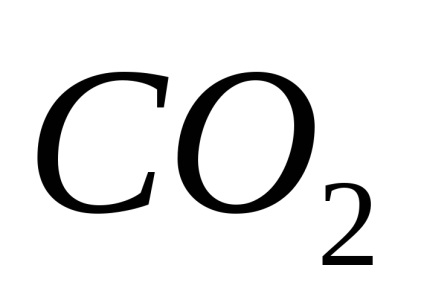
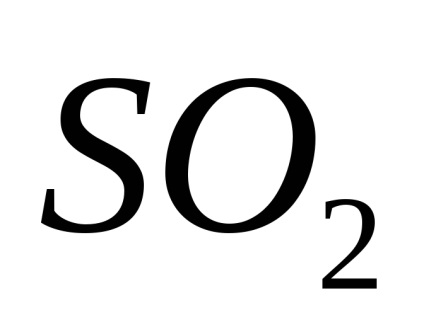
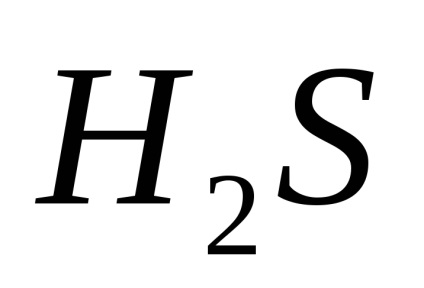
iar mediul devine acid (pH<7).
La pH valoare influențează și unele săruri care suferă hidroliză în apă.