Dacă reacția are loc prin transformarea directă a moleculelor de materii prime din molecula de produs de reacție, această reacție se numește o unitate. Cele mai multe reacții chimice care nu sunt elementare, dar includ mai multe etape elementare de conversie chimică.
Totalitatea etapelor elementare de furnizare a fluxului mecanismului de conversie chimică numită o reacție chimică complexă.
Reacțiile chimice pot avea loc peste, constând din unul sau mai multe sisteme de fază.
reacție chimică în interiorul unei faze se numește omogenă. spațiu de reacție în acest caz este un sisteme lichide sau gazoase.
Reacțiile chimice la interfața dintre cele două faze se numește eterogen, iar camera de reacție este o interfață de suprafață.
Acest program de instruire se referă la elementele de bază ale teoriei reacțiilor chimice omogene în sisteme închise la volum constant în condiții izoterme.
Rata de reacție chimică
Rata de reacție chimică v pe substanța i -lea numită o modificare a valorii ni substanței (în moli) per unitate de timp și pe unitate spațiu de reacție V:
unde V - volumul (spațiul de reacție).
Această determinare a ratei componentei este cea mai generală și este valabil pentru orice reacții complexe și orice reactiv în orice condiții.
În cazul în care volumul sistemului în timpul reacției nu este schimbat, este posibil să se facă un semn diferențial, în timp ce
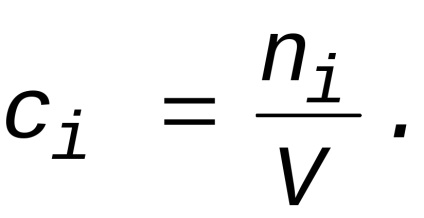
Apoi, în loc de (1) obținem
unde ci - concentrația considerat ith substanță la un moment dat. Astfel, pentru un proces chimic omogenă, care are loc la proces constant viteza de volum în funcție de o anumită substanță se spune ca i-i -lea modificare a concentrației substanței pe unitatea de timp. Dimensiunea vitezei în acest caz este egal mol / (ls) sau mol / (lmin).
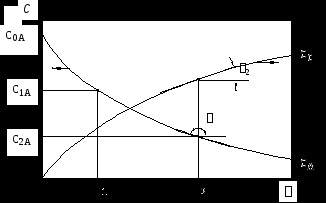
La examinarea cinetica reacțiilor chimice într-un sistem închis, de obicei, a studiat dependența experimental a concentrației unui component (i -lea substanță) în funcție de timp și arată această relație ca CI grafic = f (), care se numește curba cinetică (vezi. Fig. 1 ).
Dacă sistemul este o reacție chimică
unde a, b, c, d - coeficienți stoichiometrice, modificarea concentrației unuia dintre materiile prime (de exemplu, A) și unul dintre produsele (de exemplu, C) de timp pot fi reprezentate grafic după cum urmează:
curbele cinetice
Distinge viteza medie:
și viteza reală:
Curbele cinetice tangente, tangentele sunt unghiuri egale
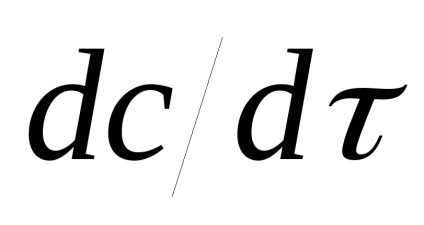
Viteza de reacție este întotdeauna pozitiv. Cu toate acestea, în cazul în care timpul de reacție a scăzut concentrația materiilor prime și produșii de reacție - creștere (Figura 1.). Ca urmare, raportul derivatului
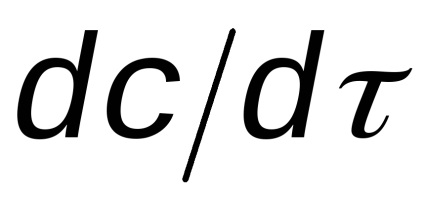
In general, viteza de reacție curge prin ecuația (3) poate fi reprezentată prin următoarea expresie:
De exemplu, pentru reacția
Formal, acest lucru poate fi scris ca
unde -1, -1, și 2 - coeficienți stoechiometrici este supus regulii semnelor menționate mai sus (pentru materii prime, coeficienți stoechiometrici primit negativ). Viteza de reacție depinde de o serie de factori (concentrație, presiune, temperatură, catalizator, etc.).
Legea de bază a cinetica chimică este legea acțiunii de masă (ZDM) montat Guldberg și Waage în 1867 an, care exprimă dependența vitezei de reacție de concentrația reactanților: la o reacție chimică unilaterală rată de temperatură constantă este proporțională cu produsul concentrațiilor reactanților în grade corespunzătoare.
Conform ZDM de reacție (3), se poate scrie ecuația
dependența de concentrație a vitezei de reacție se numește ecuația cinetică.
Factorul de proporționalitate K în ecuația (9) este constanta de viteza a unui proces chimic. Fizic K este viteza în sine, atunci când concentrația fiecăruia dintre reactanți este egal cu unitatea. Constanta ratei depinde de toți factorii care afectează viteza de reacție, cu excepția concentrațiilor reactanților și a timpului. Valoarea numerică a K depinde și de unități de temporizare și de concentrare. Dimensiunea este determinată de ecuația cinetică, în care se calculează, adică, depinde de valorile exponenților concentrațiile reactanților.