Printre halogenurile deosebit de clorură de importanță.
In laborator, clorura de hidrogen poate fi obținut prin încălzirea clorură de sodiu solidă cu acid sulfuric concentrat. Pentru acest tub cristalină de clorură de sodiu a fost adăugat acid sulfuric concentrat. Cap dopul flaconului cu un tub de evacuare a gazului a cărui extremitate a fost plasat într-un flacon cu apă.
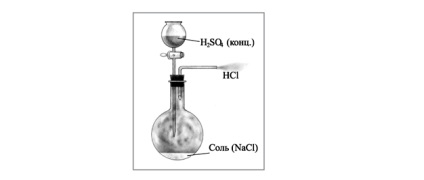
Reacția merge bine și fără încălzire, dar poate fi ușor încălzit, acid clorhidric este selecție intensă dacă vasul corespunzător cu amestecul de reacție. Datorită solubilității ridicate de acid clorhidric în apă este necesar să se respecte măsurile de siguranță. Pentru a preveni pătrunderea acidului clorhidric gazos în tubul de aer cu apa necesară pentru a acoperi bumbac ușor umezită cu apă.
Datorită solubilității ridicate a tubului de evacuare a gazului acid clorhidric gazos nu trebuie scufundat în apă. În caz contrar, apa poate fi tras în tub, în care acidul sulfuric concentrat.
In industrie, acid clorhidric se prepară sintetic, legătură directă cu acid clorhidric. Un alt mecanism interesant de interacțiune a clorului cu hidrogen. Sub efectul luminii strălucitoare se produce legături nepolare ruptură covalente din molecula de clor. Ca rezultat, atomii de clor sunt formate cu un singur electron nepereche (radicali clor). Ele sunt foarte activi și să reacționeze cu molecula de hidrogen. Molecule format acid clorhidric și atomi de hidrogen, cu un electron nepereche (radicali de hidrogen). Acestea, la rândul lor, acționează pe molecula de clor, formând astfel o molecula de acid clorhidric gazos și radical clor. Astfel de reacții sunt numite în lanț. apar în lanț de reacții de combustie mecanism, explozii.
Acidul clorhidric gazos - gaz incolor puțin mai greu decât aerul, cu un miros ascuțit, fum în aer umed.

Acidul clorhidric este una dintre cele mai substanțe gazoase solubile în apă. La 1 litru de apă la temperatura camerei, poate fi dizolvat până la 500 l de acid clorhidric.
O soluție de acid clorhidric în apă cu apel de acid clorhidric (clorhidric). Cererea principală de acid clorhidric - obținerea de acid clorhidric.
Acid clorhidric concentrat - fum soluție incoloră în aer umed, cu un miros ascuțit de acid clorhidric. Este posibil să se obțină o soluție 40% de acid clorhidric.
Acidul clorhidric are un număr de proprietăți caracteristice majorității acizilor. Astfel de proprietăți includ indicatori de culoare schimbare (turnesol, metil oranj) în roșu, precum și interacțiunea cu metale, în picioare într-o activitate rând la hidrogen, cu oxizi de bază și amfoteri, cu baze, săruri cu acizi slabi.
HCl + NaOH → NaCl + H2O
În aceste reacții, obținut a sării clorhidrat - cloruri și alte produse.
O proprietate speciala de acid clorhidric - reacția cu soluție de azotat de argint.

Folosind această reacție, acidul clorhidric se poate distinge de alți acizi. Pentru o cantitate mică de acid clorhidric în soluție de nitrat de argint mic tide vitro. Observăm apariția precipitat cazeoasă alb de clorură de argint, care este insolubilă în acid azotic. HCl + AgNO3 → AgCl ↓ + HNO3. Sărurile acidului clorhidric se numesc cloruri. Ele sunt solubile în apă, cu excepția clorurii de argint și clorură de plumb (II).
Dacă vom adăuga la o soluție de clorură de sodiu, azotat de argint, căderea aceluiași precipitat Curdy alb: NaCl + AgNO3 → AgCl ↓ + NaNO3. nitrat de argint (sau nitrat de argint) servește ca reactiv în acid clorhidric și sărurile acestora. Această reacție se numește reacția calitativă. Cu această reacție calitativă recunosc acidul clorhidric și sărurile acestora.
Acidul clorhidric este utilizat în diferite domenii ale economiei naționale.

Un număr mare de oțel când își petrece gravură înainte de acoperirea produselor din oțel strat de protecție din metal (placare staniu, nichelare, cromare). Înainte de aceste procese este necesară pentru a elimina pelicula de oxid de pe suprafața produsului. Un dezavantaj al acestei proceduri este acela că acidul reacționează nu numai cu oxid de fier, dar, de asemenea, cu metalul. Pentru a evita reacția acidului cu un metal în acid adăugate substanțe speciale - inhibitori, încetinesc reacția nedorită.
Acidul clorhidric este utilizat în fabricarea de medicamente, coloranți, pesticide, materiale plastice și alți polimeri, și pentru a obține clor în laborator și anumite cloruri.
Pentru proiectarea vizuală a surselor utilizate: