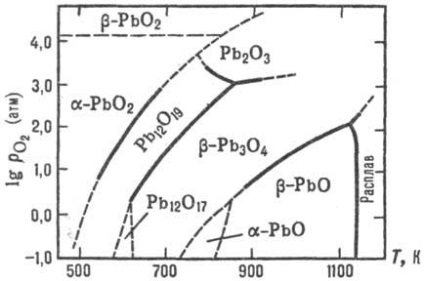
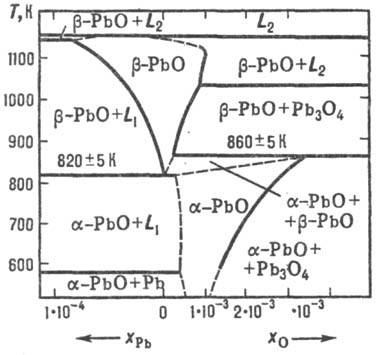
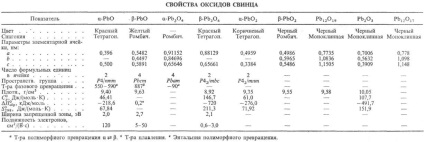
oxid de PbO există în două versiuni: un -RbO nizkotemperaturnoy- (mineral litargă) și -RbO vysokotemperaturnoy- b (mineral masicot). Compozițiile lor se pot abate de la limita de stoechiometrică ITS omogenitate prezentat în Fig. 2. tranziție polimorfic b. o mai lent decât o. b. b -RbO, prin urmare, poate exista la cameră t-re în starea metastabilă, dar merge pe triturare într-un PbO. PbO se evaporă congruență-.entno în DOS. ca Pb2 O2 și O4 RB4. dependența ur-set de temperatură a presiunii de vapori peste -RbO solid b: lgp (Pa) = 13,71-13,86 × 10 3 / T (887-1151 K). Posedă-semiconductor de legare, în funcție de compoziția (în regiunea de omogenitate) are o conductivitate electrică sau de tip p, r scade brusc la iluminare.
În aer la 540 ° C PbO oxidat la RB3 O4. la 330 ° C până la Rb12 O19. la 370 ° C până la Rb12 Ø17. și între H2 sau CO redus la metal. P-rimost (% în greutate) în apă la 20 ° C: un -RbO - 0,6 · 10 -3. b PbO-1,2 · 10 -3. Buna solubilitate. o H N O3 și HC1O4 p-D. mai rău în clorhidric și sulfuric k minute datorită formării de slab solubil p-RbS12 și PbSO4. Sol. în baze p pax. formând gidroksoplyum-Baty (II), de exemplu. Na2 [Pb (OH) 4].
Preparat prin fierbere PbO Pb (OH) 2 D p-NaOH, și un mare exces de alcalii produs o PbO, dar cu o mai mică - b -RbO. La mult timp. tranziția la fierbere se produce b. a. b -RbO sunt: termică convențională. RbSO3 descompunere sau Pb (NO3) 2. oxidarea Pb topi (650-700 ° C), într-un flux de O2 sau aer. oxidarea svinetsorg de vapori. compuși (preparați ca Naib. produs pur), PbO utilizate în producție-ve miniu. Compuși al. Pb, sticlă cu plumb (flantglas cristal) și glazuri. la pictura de sticlă și porțelan. la fabricarea lacurilor. Este folosit ca fotochuv-stvit. vidicon materiale.
Ortoplyumbat (IV) de plumb (II) (miniu) Rb3 O4 există în două modificări: a-temperatură joasă și înaltă b; în aer peste 570 ° C se descompune PbO; ur-set temperatură presiune dependență lgpO2 (Pa) = descompunere 15,0-8,70 × 10 3 / T. În apă, b -Rb3 O4 solubilitate proastă. solubilitate bună. să se topească. NaNO3. p-D NSLO4; atunci când este dizolvat în HNO3 format PbO2 et al. conexiuni. B -Rb3 O4 preparat prin calcinarea pulbere fină b -RbO la 500 ° C sub un flux de aer. Aplicată ca pigment pentru vopsele anticorozive și chit ca în acumulatorii cu plumb.
dioxid de PbO2 există în două versiuni; un -RbO2 în aer la descompune o încălzire. în conformitate cu schema:
PbO2 practic nici o solubilitate. în apă. sol. o p pax alcalii gidroksoplyumbatov pentru a forma (IV), de exemplu. Na2 [Pb (OH) 6]; când alierea cu oxizi de bază formează tip plyumoaty Na4 PbO4; comburant puternic. atunci când încălzirea. cu H2 SO4 reacționează cu eliberarea de O2. și clorhidric-C12. după triturare cu S sau P roșu aprins. PbO2 a fost preparat prin oxidarea Pb (OSOOSN3) 2 înălbitor. electrochimice. Sărurile de oxidare a Pb (II), în descompunerea Rb3 O4 H N O3. PbO2 utilizate în acumulatorii cu plumb și ca oxidant (de ex. Deoarece componenta se potrivește cu capete).
Lit. Cabinele VA Timofeev O. fotoconductoare oxizi de plumb în electronică, L. 1979, p. 7-35; Kovtunenko PV Harif Ya. L. "Industria Electronică", 1981, în. 7-8, pp. 69-73; oxizi Kulikov I. S. termodinamicii. M. 1986, p. 115-25. Ya. L. Harif, PV Kovtunenko.