masa molara de metan
Metan (gaz metan, gaz de mină) în condiții normale este un gaz incolor, posedă nici un miros.
Molecula are formă tetraedrică metan (structura prezentată în Figura 1.) În hibridizarea intră toți electronii de valență de carbon, prin urmare, atomul de carbon este sp 3 -gibridizatsii.Rastvorim în etanol, eter, hidrocarburi și ușor solubil în apă (45 ml dintr-un 1 l de apă la 20 ° C).
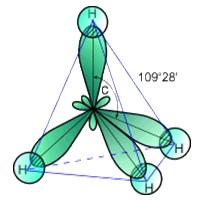
Fig. 1. Structura moleculei de metan.
Formula moleculară metan - CH4. După cum se știe, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor cuprinzând molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Dl (CH4) = Ar (C) + 4 × Ar (H);
Dl (CH4) = 12 x 4 + 1 = 12 + 4 = 16.
masa molara (M) - este greutatea 1 mol de substanță. Este ușor de a arăta că valorile numerice ale M masa molară și masa moleculară relativă Mr sunt egale, dar prima valoare are dimensiunea [M] = g / mol, și un al doilea adimensionale:
Aceasta înseamnă că masa molară de metan este de 16 g / mol.
Masa molară a substanței în stare gazoasă poate fi determinată folosind conceptul de volumul său molar. Pentru a găsi acest volum ocupat în condiții normale, o anumită masă a substanței, iar apoi se calculează greutatea de 22,4 litri de acest material, în aceleași condiții.
Pentru atingerea acestui scop (calcularea masei molare) poate folosi legea gaz ideal (ecuația Mendeleev-Clapeyron):
unde p - Presiune gaz (Pa), V - volumul de gaz (m 3), m - masa substanței (g), M - masa molară a materialului (g / mol) T - temperatura absolută (K), R - este constanta universală a gazelor egal cu 8.314 J / (mol x K).
Exemple de rezolvare a problemelor
Prepararea compusului cu formula de hidrogen, iod și oxigen, în cazul în care fracțiile masice ale elementelor în ea: w (H) = 2,2%, ω (I) = 55,7%, ω (O) = 42,1%.
fracțiunea de masă a elementului X în compoziția moleculei HX calculată cu următoarea formulă:
ω (X) = n × Ar (X) / M (HX) x 100%.
Notăm numărul de moli de elemente ale conexiunilor pentru „x“ (H) „y“ (iod), «z» (oxigen). Apoi, raportul molar va fi după cum urmează (valorile maselor atomice relative luate din Mendeleev Tabelul periodic, rotunjită la numere întregi):
x: y: z = ω (H) / Ar (H). ω (I) / Ar (I). ω (O) / Ar (O);
x: y: z = 2,2 / 1. 55,7 / 127: 42,1 / 16;
x: y: z = 2,2. 0,44: 2,63 = 5. 1. 6.
Prin urmare, compusul cu formula hidrogen, iod și oxigen va arata H5 IO6.
Asigurați formula potasiu, sulf și oxigen, în cazul în care fracțiile masice ale elementelor din ea: ω (K) = 30,75%, ω (S) = 25,21%, ω (O) = 44,04%.
fracțiunea de masă a elementului X în compoziția moleculei HX calculată cu următoarea formulă:
ω (X) = n × Ar (X) / M (HX) x 100%.
Notăm numărul de moli de elemente ale conexiunilor pentru „x“ (potasiu) „y“ (sulf), «z» (oxigen). Apoi, raportul molar va fi după cum urmează (valorile maselor atomice relative luate din Mendeleev Tabelul periodic, rotunjită la numere întregi):
x: y: z = ω (K) / Ar (K). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 30,75 / 39. 25.21 / 32: 44.04 / 16;
x: y: z = 0,78. 0,78: 2,75 = 1. 1. 3.
De aceea formula de potasiu, sulf și oxigen vor fi sub formă de SO3.