carbonat de magneziu de disociere se produce conform reacției:
Pentru a determina potențialul izobarice-izotermă, avem nevoie pentru a calcula entalpia și entropia reacției:
rasschitvaetsya entalpie prin formula:
potențial izobară-izotermă (energie Gibbs) la o temperatură de 298 K este egal cu:
Am găsit un potențial izobară-izotermă la temperaturi de 350 0 C la 500 0 C,
650 0 C și 800 0 C.
Se calculează coeficienții ecuației
Se calculează entalpia de reacție la o temperatură de 350 0 C (623 K), bazată pe substanța cu formula capacității calorice izobară și ecuația Kirchhoff:
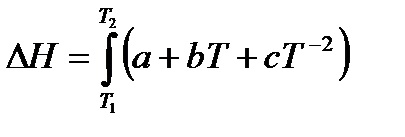
entropia absolută a reacției la o temperatură dată este egală cu:
In mod similar, calculele făcute pentru o temperatură de 500 0 C (773 K), 650 0 C (923 K) și 800 0 C (1073 K).
Rezultatele sunt prezentate în Tabelul 4.
2.4 Construirea unui grafic al T = f (# 8710; G)
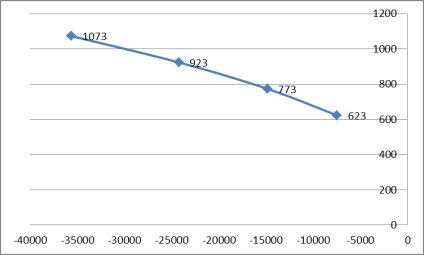
Fig. 2. Un grafic al T = f (# 8710; G)
În cursul reacției este influențat de o combinație de doi factori: factorul de schimbare a entalpiei și entropiei schimbă factor.
Există trei combinații posibile:
1. Reacția are loc în direcția reducerii creșterii entalpiei și entropiei. În astfel de cazuri, modifica potențialul izoterme izobară (energia liberă Gibbs) este mult mai mică decât zero. Pentru astfel de reacții caracterizate prin scurgere rapidă și ireversibilă.
2. Unul dintre factorii este favorabil, celălalt nu: și:
a) Modificări ale energiei libere Gibbs este negativ - reacția are loc, dar de obicei, nu tot drumul la o stare de echilibru;
b) Reacția are loc fără o schimbare a energiei libere Gibbs - în acest caz, echilibrul sistemului;
c) Schimbarea energiei Gibbs pozitiv - reacție care curge.
3. Ambii acești factori sunt nefavorabile - în acest caz, schimbarea energiei Gibbs este mult mai mare decât zero. Un astfel de proces este interzisă de legile termodinmiki.
Calculele pentru datele de temperatură dau rezultate care sunt potrivite pentru cazul 2a.
Pe parcursul acestei lucrări a fost determinat debitul de aer, volumul de produse de ardere și a potențialului izobară-izotermă computerizata (energie Gibbs), la temperaturi de 350, 500, 650, 800 0 C. construit un grafic al T = f (# 8710; G), care în mod clar arată că schimbarea de energie Gibbs este negativ - reacția are loc, dar, de regulă, nu tot drumul la o stare de echilibru.
Lista literaturii second-hand
1. DA Diomidovsky „metalurgia feroasă cuptor metalurgic“, 1970;
3. VV Nashchokin "Termodinamica Engineering", 1975;
4. VN Zubarev „Atelier de lucru pe termodinamicii tehnice“ 1986.