În natură, soluțiile sunt adesea separate printr-o membrană permeabilă pentru acoperișuri la molecule de solvent. În astfel de cazuri, între ele există NE-Lenie numit osmoză. Osmoza - o infiltrare spontană a moleculelor de solvent prin membrană dintr-o soluție de solvent sau dintr-o soluție cu concentrație scăzută într-o soluție cu o concentrație mai mare a substanței.
Pentru osmoza ocurență sunt aduse în contact soluțiile necesare concentrații diferite printr-o membrană semipermeabilă, al cărui rol pentru soluții apoase se pot efectua ca animal și membrană vegetală (vezică bovină manta, peretele intestinului, membranele celulare) și membrane artificiale (film colodiu, celofan, ferocianurile cupru).
Cea mai simplă metodă de măsurare a preveni excesivă hidrostatic-ment este prezentată în Figura 1.6.
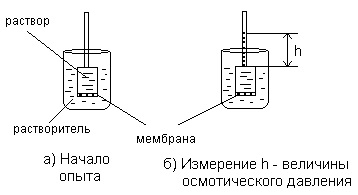
Fig. 1.6. Măsurarea presiunii hidrostatice în exces
Înălțimea coloanei de lichid din unitatea cilindru tub (aria secțiunii transversale luată egală cu 1 cm2), la care se stabilește echilibrul dinamic, determină presiunea osmotică a soluției.
Presiunea osmotică este direct proporțională cu numărul de molecule sau particule coloidale conținute într-o unitate de volum de soluție, adică, este direct proporțională cu concentrația soluției. Mai mult, presiunea osmotică este direct proporțională cu temperatura. Van't Hoff unit aceste două modele, reducându-le într-o singură formulă (van't ecuația Hoff):
π - presiunea osmotică;
c - concentrația soluției în mol / l;
R - coeficientul de proporționalitate (gazul universal
În cazul în care concentrația soluției este de 1 mol / l, în conformitate cu presiunea legii osmotici van't Hoff a soluției la O ° C, este egal cu:
Π = 0082. 273 = 22,4 atm.
Dacă luăm în considerare că particulele coloidale de multe ori mai mari decât particulele de soluții adevărate, apoi pentru aceeași concentrație de greutate a acestor soluții pe unitatea de volum a particulelor de sol conține mult mai puțin decât aceeași cantitate de soluție adevărată. Ca urmare, presiunea osmotică a coloizilor este foarte mică în comparație cu cele de soluții adevărate. Astfel, presiunea osmotică a unei soluții de glucoză 1% este egal cu 509 mm coloană de mercur picior, în timp ce presiunea de 1% oxid de sol arsenic (AS2 O3) - 0,026 mm Hg. Art.
Exemplu. Calculați presiunea osmotică a unei soluții 0,5 M zaharoză la 37 ° C
Presiunea osmotică se calculează cu formula:
π = 0,5. 0.082. (273 + 37) = 0,5. 0.082. 310 = 12,7 (atm.)
În plus, coloizilor au scădere foarte mică creștere de congelare și de fierbere puncte rata peratura în comparație cu aceste proprietăți ale soluțiilor adevărate.
Semnificația biologică a fenomenului de osmoză
Prin osmoză apar hidratarea celulelor, care le dă forma, cauzele turgor, ajutând la menținerea elasticității și rezistența. Apa este esențială pentru reacțiile celulare dintr-o multitudine de -. Hidroliza, hidratarea, oxidarea, etc. Pentru membranele celulare de ioni de sodiu și potasiu sunt impermeabile (există „pompe“ pentru re-nas prin membrana).
Dacă presiunea osmotică a soluției este egală cu cea a soluției standard, această soluție se numește izotonică; în cazul în care presiunea fluidului este mai mare decât presiunea standard a soluției, soluția este hipertonică, iar dacă aceasta este mai mică decât presiunea soluției etalon - soluția hipotone. Soluția etalon este considerată a fi sisteme de fluide ale corpului. Sângele, limfa, lichidul tisular - sunt soluții apoase ale multor molecule și ioni diferiți. Lor osmotică totală sub presiune la 37 ° C egală cu 7,7 atm. care contribuie la hidratarea adecvată a celulelor și a structurilor intercelulare și fluxul normal de diverse procese fizice și chimice. Aceeași presiune este de 0,9% (sau 0,15 M) soluție de clorură de sodiu. Această soluție se numește fiziologic. Acum, pentru a adăuga alte săruri, proteine, etc.
Dacă celulele plasate într-o soluție hipotonă, de exemplu, măsuri care trăiesc în apă, se umflă la intrarea moleculelor de apă și se sparge. Acest fenomen este denumit liza. În cazul liza celulelor roșii din sânge a fost numit hemoliza, ca în același timp, în afara cuștii out hemo-globina, iar apa devine roșu,
Soluțiile hipertonice apa, dimpotrivă, părăsește celula, și se micșorează. Acest fenomen - plasmoliza.
La animalele superioare și la om osmotic oferind Lenie foarte consistent. Acest fenomen se numește izoosmiey OMM-l DIT în conceptul de homeostaziei. Scăderea presiunii osmotice prin introducerea unor cantități mari de apă sau ca urmare a sărurilor intensive-ter cu sudoare, urina poate provoca vărsături, convulsii și chiar moarte.
Creșterea presiunii osmotice introducerea sărurilor de mari onoruri coli conduce la o redistribuire a sărurilor. Apa colectează Xia în acele țesuturi în care cantitatea depusă de săruri în exces, provocând umflarea lor, în timp ce deshidratarea membranelor mucoase provoaca sete, perturba funcționarea normală a sistemului nervos si a altor organe.