Duritatea apei este setul de proprietăți datorită prezenței de calciu solubil în apă și săruri de magneziu.
Conceptul de duritate a apei este de obicei asociată cu cationi de calciu (Ca2 +) și într-o măsură mai mică de magneziu (Mg2 +). Ei interacționează cu anioni pentru a forma compuși (săruri gest oase) sunt capabili să precipite. cationi monovalenți (de exemplu, sodiu Na +, K +) nu au o astfel de proprietate. Contribuția altor cationi bivalenți în duritatea apei nu este de obicei semnificativ.
Tipuri de rigiditate.
Următoarele tipuri de rigiditate.
Duritatea totală este determinată de concentrația totală de ioni de calciu și magneziu. Reprezintă suma carbonatului (timp) și uncarbonate rigiditatea (constantă).
Duritate în apă datorită prezenței carbonaților și bicarbonaților (pH> 8,3), calciu și magneziu. Acest tip de rigiditate este aproape complet eliminată prin apa de fierbere și, prin urmare, se numește duritate temporară. Când hidrogencarbonați apa încălzită se descompun pentru a forma acid carbonic (H2CO3) și precipitarea carbonatului (CaCO3), calciu și hidroxid de magneziu (Mg (OH) 2).
rigiditate Noncarbonate datorită prezenței de săruri de calciu și magneziu ale acizilor tari (sulfuric, clorhidric) și persistă (duritate permanentă) la fierbere.


Anionii, cel mai frecvent întâlnite în apă naturală:
Anioni Balance care chisloty
Bicarbonat (HCO3-) Cărbune
Carbonate (CO32-) Cărbune
Sulfat (SO42-) Sulfuric
Cloruri (Cl-) Sare
Azotat (NO3) nitric
Anionii, cel mai frecvent în apă naturală: Unități de rigiditate.
În lumea practica unele unități de rigiditate, toate acestea într-un anumit fel legate una de cealaltă. În România Gosstandard ca unitatea este instalată apă de duritate mol pe metru cub (mol / m3).
În plus, în țări străine sunt unități utilizate pe scară largă de severitate, cum ar fi grade germane (do, dH), grade franceze (FO), un grad american, ppm CaCO3.
Raportul dintre unitățile de rigiditate reprezentate în tabelul următor:
Unități de duritate a apei
Mol / m3 (mEq / l) gradul german, face grade franceze, FO grad ppm american (mg / dm3) CaCO3
1000 2804 5005 50050 50050
Notă:
Un grad german corespunde la 10 mg / dm 3 sau CaO 17,86 mg / CaCO3 dm3 în apă.
Un grad corespunde francez la 10 mg / dm3 CaCO3 în apă.
Un grad american corespunde la 1 mg / dm3 CaCO3 în apă.
Originea rigidității
Ionii de calciu (Ca2 +) și magneziu (Mg2 +), și alte metale alcalino-pământoase care provoacă rigiditate, prezentă în toate apele mineralizate. Acestea sunt o sursă de depozite naturale de calcar, gips și dolomită. Ionii de calciu și magneziu în apa alimentată prin interacțiunea dioxidului de carbon dizolvat din minerale și alte procese de dizolvare și alterarea chimică a rocilor. Sursa acestor ioni pot servi, de asemenea, procesele microbiologice, care apar în sol pe zona, în sedimente și ape reziduale din diferite întreprinderi.
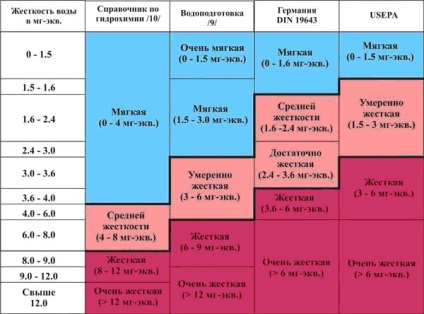
Duritatea apei variază în limite largi și există mai multe tipuri de grad clasificări de apă de rigiditate. Tabelul următor prezintă clasificarea întregii patru exemple. Două clasificări ale surselor românești - din directorul „indicatori hidrochimici ai mediului“ și manualul pentru licee „Apa“ / 9 /. A doua - din străinătate: reguli de rigiditate a Institutului German pentru Standardizare-TION (DIN 19643) și clasificarea adoptată de către Agenția SUA pentru Agenția de Protecție a Mediului (USEPA), în 1986.
Tabelul arată în mod clar mult mai abordare „greu“ la problema rigidității „ei.“ Mai mult decât atât, există motive pentru ei - de mai jos.
efect asupra calității apei anchilozare
În ceea ce privește utilizarea apei potabile, acceptabilitatea acesteia de gradul de rigiditate variază semnificativ în funcție de condițiile locale. Pragul de gust pentru minciuni de ioni de calciu (în raport cu mg echivalent) în intervalul 2-6 meq / l, în funcție de anionul corespunzător, iar pragul de gust pentru magneziu și chiar mai mici. În unele cazuri, apa acceptabile pentru consumatori, cu o duritate mai mare de 10 mEq / l. rigiditate mare afectează proprietățile organoleptice ale apei, conferindu-i un gust amar și care au un efect negativ asupra organelor digestive.
Cu toate acestea, în funcție de pH-ul și alcalinitatea, apa cu o duritate de peste 4 meq / l pot determina sistemul de distribuție la depunerea de zgură și nămol (carbonat de calciu), mai ales atunci când este încălzit. Acesta este motivul pentru inspecție normele cazan introduce cerințe foarte stricte privind valoarea durității apei utilizate pentru cazane de putere (0,05-0,1 mg echivalent / l).
Mai mult decât atât, în interacțiunea cu săruri ale durității detergenți (săpunuri, detergenți, șampoane) se formează „zgură de săpun“, sub formă de spumă. Acest lucru duce nu numai la detergenți semnificative depășirilor de costuri. O astfel de spumă după uscare este sub formă de depuneri pe corpuri sanitare, haine, piele umană, părul (senzația neplăcută de păr „rigid“ este bine cunoscut de mulți). Principalul impact negativ al acestor toxine asupra omului este că ei distrug filmul gras natural, care este întotdeauna acoperit cu piele normala si astupa porii acestuia. Un semn al acestei este impactul negativ al unui „zero“ tipic piele spălate curat sau păr. Se pare că provocând un sentiment de iritare „de formare a spumei“ după utilizarea de apă moale, este un semn că filmul gras protector pe piele nevătămat. Era ea și slide-uri. În caz contrar, este necesar să se cheltuiască bani pe loțiuni, înmuind și creme și alte trucuri pentru restaurarea protecției pielii, care ne-a și așa Mama Natura a oferit.
În același timp, este necesar să se menționeze de cealaltă parte a monedei. apa moale cu o duritate mai mică de 2 mEq / L are o capacitate scăzută de tampon (alcalinitate) și poate, în funcție de pH și de alți factori, au un nivel crescut de efecte corozive asupra conductelor de apă. Prin urmare, într-un număr de aplicații (în special în domeniul ingineriei de căldură) este uneori necesar pentru a efectua un tratament special al apei, în scopul de a obține un echilibru între duritatea apei și corozivitatea acesteia.
dedurizarea apei
Eliminarea durității apei - înmuiere, în tratarea modernă a apei, de regulă, realizată în următoarele moduri:
- schimb de ioni;
- Osmoza inversă:
Alte metode de a modifica compoziția chimică a soluției în timpul de înmuiere, există modalități de „mascare“ duritatea apei. Ele se bazează pe adăugarea de substanțe în apă pentru a preveni precipitarea nămolurilor sărurilor de duritate - nămol. Pentru apa industrială este cel mai frecvent utilizat polifosfat de sodiu (bine-cunoscut „Calgon“). Acesta se leagă ionii de calciu și nu formează precipitate.
În cazul apei potabile, uneori, apă „inmuiere cvasi“ acidulată prin introducerea ionilor de hidrogen (H +). Într-un mediu acid nu există nici o pierdere a durității sărurilor precipita și clientul percepe, cum ar fi apa demineralizata. Mai mult decât atât, această metodă vă permite să obțineți o cotă mai mare a modulului, în comparație cu posibilitățile de înmuiere „adevărat“. De exemplu, purificatoare de apă funcționează marca „Brita“.
Această metodă este toate bune, cu excepția faptului că acidifierea excesivă a apei - până la pH = 5, poate afecta negativ sănătatea persoanelor cu aciditate gastrică afectata. Cu toate acestea, apa potabilă trebuie să aibă un pH de cel puțin 6.
Eliminarea o rigiditate excesivă
Cele purificatoare de apă urcior Aquaphor implementat ambele metode simultan pentru a combate duritatea apei. Modulele universale V100-5 un amestec de rășini schimbătoare de ioni în formă de sodiu și hidrogen, ales astfel încât, împreună cu unele acidifierea apa a avut loc îndepărtarea parțială a ionilor de calciu.
Mai mult, amestecul de rășini în modulul are proprietăți de tamponare. Ie în cazul în care apa este inițial cu pH ridicat (> 7 apă alcalină) există o acidifiere în creștere în cazul scăzută (<7), то подкисление происходит в меньшей степени.
Același lucru se întâmplă și cu duritatea apei. În cazul îndepărtării stringență ridicată de ioni de calciu este într-o măsură mai mare în cazul „activitate“ stringență scăzută de ioni este redus de schimb.
Astfel, există o îndepărtare a excesului de duritate a apei. Cu toate acestea, trebuie apreciat că procesul de dedurizare a apei nu depinde numai de concentrația de ioni de calciu, dar și pe ei „mediu“, adică din compoziția totală a apei (model anionic, kompeksoobrazovateley prezență, pH etc.)