


Exemplul 2 Prepararea alcoolilor de hidrocarburi saturate și nesaturate. Sinteza industrială a metanolului.

3. Implementarea n s t transformări :. Sare - baze insolubile - oxid metalic.
Acidul sulfuric este reacționat cu încălzire cu oxid de cupru (II). Cu 2+ ionii trec în soluție și îi conferă o culoare albastră.
CuO + 2H + = Cu 2+ + H2O
Alcalii se adaugă la soluția de filtrat, precipitatul albastru este pierderea observată:
CuSO4 + 2NaOH = Cu (OH) 2 (oxid de cupru insolubil) + Na2 SO4,
când precipitat albastru încălzit de hidroxid de cupru (II) format substanță neagră - este oxid de cupru (II) și apă:
Cu (OH) 2 = CuO + H2O
1. oxigen superior acidChemical elemente treia perioadă, compoziția și proprietățile caracteristice comparative.
Fosforul formează un număr de acizi conținând oxigen (oxo). Unele dintre ele sunt monomeric. de exemplu fosfinic, fosforic și fosfor (V) (acid ortofosforic). Acizii de fosfor pot fi monobazic (un proton) sau multivalent (mnogoprotonnymi). Mai mult, oxoacizi de fosfor formează un alt polimer. Astfel de acizi pot avea o structură ciclică sau aciclică. De exemplu, difosforic (V) (pirofosforic) de acid este un acid oxo fosfor dimeric.
Cel mai important dintre acești acizi este fosforic (V) de acid (un alt nume sau - acidul ortofosforic). În condiții normale, este o substanță cristalină albă se răspândește în absorbția umidității din aer. soluția sa apoasă 85% cunoscută ca „acid fosforic siropos“. Fosforntsya (V) acid slab este acid tribazic:
Acid clor formează mai multe oxigenați. Cu cat mai mare oxidarea clorului în acești acizi, mai mare stabilitatea lor termică și tăria acidă:
NOCl <НСlO2 <НСlO3 <НClO4
NClO3 și NClO4 - acizi puternici și NSLO4 - una dintre cele mai puternice dintre toate acizii cunoscuți. Cele două Acidul rămas este doar parțial disociate în apă și există într-o soluție apoasă de preferință sub formă moleculară. Printre clor conținând oxigen numai NSLO4 acizi pot fi izolați într-o formă liberă. Acidul rămas există numai în soluție.
Capacitatea de oxidare a acizilor clor oxigenate scade odată cu creșterea starea de oxidare:
HOCI și NClO2 - oxidanți deosebit de bune. De exemplu, soluția acidă NOCl:
1) ionii oxideaza de fier (II) ionilor la fier (III):
2) lumina soarelui este descompus pentru a forma oxigen:
3) atunci când este încălzit la aproximativ 75 ° C, se disproportionates la ionii de clor, și clorat (V) -ions:
Elementele rămase ale acidului conținând acid mai mare a treia perioadă (H3AlO3, H2SiO3) mai slab decât acidul fosforic. Acid sulfuric (H2SO4) silnae mai mic de acid cloric (VII), dar mai puternic decât acidul fosforic. In general, cu creșterea gradului de oxidare a elementului care formează acidul crește tăria acidului însuși:
H3AlO3 2. Caracteristicile generale ale compușilor cu masă moleculară: compoziția, structura, reacțiile care stau la baza prepararea acestora (de exemplu, polietilenă sau din cauciuc sintetic).

3. 3a și d și h. Calcularea masei materiei prime, dacă se cunoaște randamentul practic al produsului și conține o fracție de masă (procente) din teoretic posibil randamentul.
Sarcină. Se determină greutatea de carbonat de magneziu, reacționează cu acid clorhidric, în cazul în care astfel obținut 8,96 litri de monoxid de carbon (IV), care este de 80% din teoretic posibil randamentul.

Metode comune de metale care produc. Importanța practică pentru săruri acide anoxie electroliză Exemplu.
Metalele sunt în primul rând de natură în forma Cps-Neny. Numai metale cu reactivitate scăzută (metale bun-familie) apar în mod natural în stare liberă (metalele de platină, aur, cupru, argint, mercur). Din metale con struktsionnyh în cantități suficiente, sunt disponibile în natură sub formă de compuși numai fier, aluminiu, magneziu. Ele constituie depozite potenti rezervor relativ minereuri bo-gatyh. Acest lucru facilitează producția lor pe scară largă.
Deoarece metalele din compușii sunt într-o stare oxidată (au starea de oxidare pozitivă), ei semi-chenie în stare liberă se reduce la RESET ment al procesului:
Acest proces poate fi realizat prin mijloace chimice sau electro-chimice.
În reducerea chimică ca agent reducător de cărbune sau oxid de carbon cel mai frecvent utilizate (II), și hidrogen, metale active de siliciu. Utilizarea oxidului de carbon (II) a fost preparat de fier (în procesul de furnal), multe metale de culoare de tranziție (staniu, plumb, zinc și altele.):
reducerea hidrogenului este utilizată, de exemplu, în radiație din oxid de wolfram, tungsten (VI):
Utilizarea hidrogenului ca agent de reducere asigură cea mai mare puritate a metalului. Hidrogenul este utilizat pentru obținerea unui fier, cupru, nichel, și alte me-taliu foarte pură.
Procedeu de obținere a metalelor, în care metalele folosite RESET-NOVITEL denumit metalotermică. În această metodă, utilizată ca un metale activ reducătoare. Exemple reacții metalotermică:
Experimentele metalotermică produc de metal pentru prima dată o viespe-exista om de știință român NN Beketov în secolul al XIX-lea.
Metale cel mai frecvent preparate prin reducerea hidroxi-rânduri, care la rândul său este izolată de la respectivul nativ minereu. În cazul în care mina de minereu inițial sunt sulfura-Rala, acesta din urmă este supus oxidativă calcinare într-un exemplu:
producția electrochimică a metalelor se realizează prin electroliza topiturilor compușilor corespunzători. Acest lucru dă metale mai active, alcaline Shte metale lochnozemelnye, aluminiu, magneziu.
Reducerea electrochimică, de asemenea, utilizat pentru-Finisare ra (curatarea) metale „brute“ (cupru, nichel, zinc, etc.), obținute prin alte metode. La rafinarea electrolitică într-un anod folosind „blister“ (cu at-mesyami) de metal într-un electrolit - soluție de compuși metalici.
Metodele de producere a metalelor realizate la temperaturi ridicate, numite pirometalurgică (pyr grecesc - foc). Multe dintre aceste metode au fost cunoscute inca din cele mai vechi timpuri. La rândul său secolelor XIX-XX. încep să se dezvolte metode hidro-metalurgice pentru metale producătoare (hydor apă greacă). În aceste procese, componentele minereului este transformată într-o soluție apoasă și apoi izolat din metal sau electroliză prin reducerea chimică. Astfel preparat, de exemplu, cupru. Un oxid de cupru minereu conținând cupru (II) CuO, tratat cu acid sulfuric diluat:
Pentru a recupera cupru rezultată soluție de sulfat de cupru (II), sau supus electroliză sau acționează asupra soluției de pulbere de fier.
proces hidrometalurgice are un mare viitor, deoarece permite obținerea unui produs fără a extrage minereu de la sol.
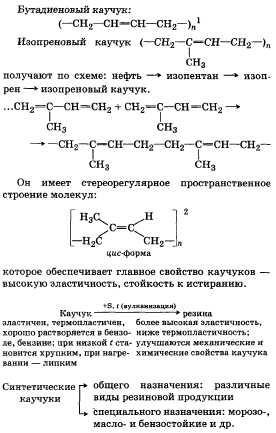
2. Tipuri de cauciucuri sintetice, proprietățile și utilizările lor.

3. Prepararea n t s a numitei substanțe gazoase și efectuarea reacțiilor care caracterizează proprietățile sale .; (Dioxid de carbon)
C02 - este un oxid tipic acid: este reacționat cu alcalii (de exemplu, apa de var este neclară), cu oxizi de bază și apă.
Dioxidul de carbon este obținută prin acționarea asupra sării carbonat - carbonați soluții de acid clorhidric, acid azotic și acid acetic chiar. In laborator, dioxidul de carbon produs prin acțiunea cretă sau de acid clorhidric marmura:
CaC03 + 2HCl = CaCl2 + H20 + C02 este dioxidul de carbon
În industrie, cantități mari de dioxid de carbon obținut prin arderea calcarului:
CaC03 = CaO + CO2
Reacțiile chimice cu dioxid de carbon
Când dizolvarea oxidului de carbon (IV) Formele N2S03 acid carbonic, care este foarte instabil și ușor de descompus în componentele inițiale în apă - dioxid de carbon și apă:
CO2 + H20 -> H2CO3
Ea nu arde sau suport de ardere (fig. 44) și, prin urmare, este utilizat pentru stingerea incendiilor. Cu toate acestea, magneziu rămâne în oxid de dioxid de carbon pentru a forma și eliberarea de carbon sub formă de negru de fum:
+ = 2mg C02 2MgO + C