sulfat anhidru de fier (III) - ușoare paramagnetice galben cristale foarte higroscopice ale sistemului de cristal monoclinic. grupul spațial P21 / m, parametrii celulei unitare a = 0,8296 nm, b = 0,8515 nm, c = 1,160 nm, β = 90,5 °, Z = 4. Există dovezi că sulfatul feric anhidru constituie ortorombică și hexagonal modificare. Solubil în apă se dizolvă lent în etanol [specificat].
Cristalizeaza din apă sub forma cristalină Fe2 (SO4) 3 · n H2O, unde n = 12, 10, 9, 7, 6, 4, 3, 1. Cel mai studiat cristalin - sulfat de fier nonahidrat (III) Fe2 (SO4) 3 · 9H2 o - cristale galbene ale parametrilor celulei unitare sunt hexagonale a = 1,085 nm, c = 1,703 nm, Z = 4. este ușor solubil în apă (440 g per 100 g de apă) și etanol (abs.). Soluțiile apoase de sulfat de fier (III), din cauza hidrolizei devine de culoare roșu-brun.
Când nonahidrat încălzit convertit la 98 ° C în tetrahidrat, la 125 ° C - și monohidratul la 175 ° C - în Fe2 anhidru (SO4) 3. care este peste 600 ° C se descompune Fe2 O3 și SO3.
Fiind în natură
formă mineralogică de sulfat de fier (III) - mikasait (. Engl mikasaite), un amestec de sulfat de aluminiu-fier. Formula sa chimică - (. Fe 3+ Al 3+) 2 (SO4) 3. Acest mineral conține sub formă anhidră de sulfat de fier, deci se găsește în natură este foarte rar. Formele hidratate apar mai frecvent, cum ar fi:
- Coquimbo (Engl coquimbite.) - Fe2 (SO4) 3 · 9H2 O - nonahidrat - cea mai comună formă în natură.
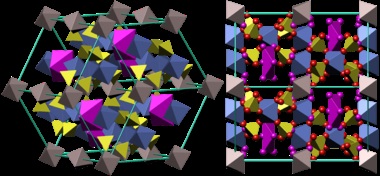
Structura cristalina kokimbita
- Parakokimbit (paracoquimbite engleză.) - un alt nonahidrat - o formă rară.
- Cornelia (kornelite născut.) - heptahidrat - (. Quenstedtite engleză) și kuenstedtit - decahidrat - prea rar.
- Lausenit (lausenite engleză.) - hexa sau pentahidrat (independența acestui mineral în cauză).
Toți hidratii naturali menționați mai sus de fier pe suprafața pământului sunt instabile. Dar stocurile lor sunt în mod constant completate datorită oxidării altor minerale (în principal, pirită și marcasite).
In industrie, sulfatul de fier (III) a fost preparat prin calcinare piritei și marcasite cu NaCl în aer:
2 F e S 2 + 2 N o C l + 8 O 2 ⟶ F e 2 (SO 4) 3 + N a 2 SO 4 + C l 2 + 2NaCI + 8O_ \ longrightarrow Fe_ (SO _) _ + Na_SO_ + Cl_> >>
sau dizolvat oxid de fier (III) în acid sulfuric:
F e 2 O 3 + 3 H 2 S O 4 ⟶ F e 2 (S O 4) 3 + 3 H 2 O + O_ 3H_SO_ \ longrightarrow Fe_ (SO _) _ + 3H_O >>>
In practica de laborator, sulfatul de fier (III) poate fi obținut din hidroxid de fier (III):
2 F e (O H) 3 + 3 H 2 S O 4 ⟶ F e 2 (S O 4) 3 + 6 H2O + 3H_SO_ \ longrightarrow Fe_ (SO _) _ + 6H_O >>>
2 F e S O 4 + H 2 S O 4 + 2 H N O 3 ⟶ F e 2 (S O 4) 3 + 2 N O 2 + 2 H 2 O + H_SO_ + 2HNO_ \ longrightarrow Fe_ (SO _) _ + 2NO_ + 2H_O >>>
Oxidarea poate fi efectuată, de asemenea, cu oxigen sau sulf oxid:
12 F e SO 4 + 3 O 2 ⟶ 4 F e 2 (SO 4) 3 + 2 F e 2 O 3 + 3O_ \ longrightarrow 4Fe_ (SO _) _ + 2Fe_O _ >>> 2 F e SO 4 + 2 SO 3 ⟶ F e 2 (SO 4) 3 + SO 2 + 2SO_ \ longrightarrow Fe_ (SO _) _ + _ SO >>>
sulfuric concentrat și acid azotic oxidează sulfura de fier la sulfatul de fier (III):
2 F e S + H 2 SO 4 + 18 HNO3 ⟶ F e 2 (SO 4) 3 + 18 NO 2 ↑ + 10 H 2 O SO_ + 18HNO_ \ longrightarrow Fe_ (SO _) _ + 18NO_ \ upArrow + 10H_O >> >
disulfura de fier poate fi oxidat cu acid sulfuric concentrat:
2 F e S 2 + 14 H 2 S O 4 ⟶ F e 2 (S O 4) 3 + 15 S O 2 ↑ + 14 H 2 O + 14H_SO_ \ longrightarrow Fe_ (SO _) _ + 15SO_ \ upArrow + 14H_O >>>
sulfat de amoniu si fier (II) (sare Mohr) poate fi de asemenea oxidat cu dicromat de potasiu. Deoarece această reacție să iasă în evidență o dată patru sulfat - fier (III), crom (III). amoniu și potasiu. și apă:
6 F e (NH4) 2 (SO 4) 2 + 7 H 2 SO 4 + K 2 C r 2 O 7 ⟶) _ (SO _) _ + 7H_SO_ + K_Cr_O_ \ longrightarrow >>> F e 2 (SO 4) 3 + C r 2 (SO 4) 3 + 6 (NH4) 2 SO 4 + K 2 SO 4 + 7 H 2 O (SO _) _ + Cr_ (SO _) _ + 6 (NH _) _ SO_ + K_SO_ + 7H_O> >>
sulfat de fier (III) pot fi preparați ca unul dintre produsele de descompunere termică de sulfat de fier (II):
6 F e O 4 S → T F e 2 (S O 4) 3 + 2 F e 2 O 3 + 3 S O 2
Ferrates cu acid sulfuric diluat se reduc la sulfat de fier (III):
4 K 2 F e O 4 + 10 H 2 S O 4 → 2 F e 2 (S O 4) 3 + 3 O 2 ↑ + 4 K 2 S O 4 + 10 H 2 O + FeO_ 10H_SO_
Atunci când este încălzit la o temperatură de pentahidrat 70-175 ° C se obține sulfat de fier anhidru (III):
X e O 3 + 3 H 2 SO 4 + 6 F e SO 4 ⟶ 3 F e 2 (SO 4) 3 + X e ↑ + 3 H 2 O + 3H_SO_ + 6FeSO_ \ longrightarrow 3Fe_ (SO _) _ + Xe \ upArrow \ + 3H_O >>>
sulfat de fier (III) în soluție apoasă este supus hidrolizei printr-un cation puternic, în care soluția este colorată într-o culoare roșu-maroniu:
F e [(H 2 O) 6] 3 + + H 2 O ⇄ F e [(H 2 O) 5 (O H)] 2 + + H 3 O +; p K = 2. 17 O) _] ^ + H_O \ rightleftarrows Fe [(H_O) _ (OH)] ^ + H_O ^;
p> = 3,26 >>> [2 F e (H 2 O) 6] 3 + 2 + H 2 O ⇄ [F e 2 (H2O) 8 (OH) 2] 4 + 3 H 2 O +; p K = 2. 91 O) _ ^] + 2H_O \ rightleftarrows [Fe_ (H_O) _ (OH) _] ^ + 2H_O ^;
apă fierbinte sau abur descompune sulfat de fier (III):
sulfat de fier anhidru (III), se descompune sub încălzire:
soluții alcaline descompun sulfat de fier (III), produsele de reacție depinde de concentrația de substanță alcalină:
F e 2 (SO 4) 3 + 2 N o OH ⟶ 2 F e SO 4 (OH) ↓ + N o 2 SO 4 (SO _) _ + 2NaOH \ longrightarrow 2FeSO_ (OH) \ downarrow + Na_SO _ >>> F e 2 (SO 4) 3 + 6 N o OH ⟶ 2 F e o (OH) ↓ + 3 N a 2 SO 4 + 2 H 2 o (SO _) _ + 6NaOH \ longrightarrow 2FeO (OH) \ downarrow + 3Na_SO_ + 2H_O >>>
Dacă substanța alcalină reacționează cu o soluție echimolară de sulfat de fier (III) și fier (II), rezultatul este un oxid complex de fier:
F e 2 (SO 4) 3 + F e SO 4 + 8 N o OH ⟶ F e 3 O 4 ↓ + 4 N a 2 SO 4 + 4 H 2 O (SO _) _ + FeSO_ + 8NaOH \ longrightarrow Fe_O_ \ downarrow + 4Na_SO_ + 4H_O >>>
metale active (... Cum ar fi magneziu, zinc, cadmiu, fier) redus de sulfat de fier (III):
F e 2 (S O 4) 3 + F e ⟶ 3 F e S O 4 (SO _) _ + Fe \ longrightarrow 3FeSO _ >>>
Unele sulfuri metalice (.... De exemplu, cupru, plumb calciu mercur staniu) într-o soluție de apă redusă de sulfat de fier (III):
C u S + F e 2 (S O 4) 3 ⟶ 2 F e S O 4 + C u S O 4 + S (SO _) _ \ longrightarrow 2FeSO_ + CuSO_ + S >>>
forme de fosfat de fier insolubil (III) cu săruri solubile ale acidului ortofosforic (heterozygosity):
F e 2 (SO 4) 3 + 2 N o H 2 PO 4 ⟶ Na- 2 SO 4 + 2 H 2 SO 4 + 2 F e PO 4 ↓ (SO _) _ + 2NaH_PO_ \ longrightarrow Na_SO_ + 2H_SO_ + 2FePO_ \ downarrow >>>
- Ca reactiv în timpul prelucrării hidrometalurgică a minereurilor de cupru.
- Deoarece coagulant în tratarea apelor reziduale, menajere și a efluenților industriali.
- Ca mordant în țesături vopsire.
- Când tăbăcirea din piele.
- Decaparea din oțel inoxidabil austenitic, aliaje de aur cu aluminiu.
- Ca un regulator de flotație pentru a reduce flotabilitatea minereurilor.
- In medicina este folosit ca un astringent și hemostatic.
- În industria chimică ca oxidant și un catalizator.