1. Numărul cuantic principal descrie:
- numărul de nivele de energie într-un atom;
- energia electronului în acest nivel de energie;
În cazul general, este nevoie de valori de la înainte. In atomii neexcitat, adică o astfel de condiție care corespunde dispunerea lor în tabelul periodic D. I. Mendeleeva variază de la în conformitate cu numărul de perioade în sistemul periodic. Cu cât mai puțin. cu atât mai mare energia electronului cu interacțiunile nucleu. De exemplu, atunci când un atom de hidrogen în starea solului, atunci când - în excitat.
In atomii multi-electroni, electroni cu aceleași valori formează un strat sau un nivel desemnat de litere și. Scrisoarea corespunde primului nivel, - al doilea, etc.
2. Numărul cuantic orbital sau laterală se caracterizează prin:
- energia electronilor în subnivelul de energie.
La nivel poate fi mulți electroni (maxim), dar nu toți au aceeași energie. Ca urmare a repulsiei reciproce a nivelului de energie de electroni este împărțit în subnivele (figura).
Figura 2.3 Separarea nivelurilor de energie în subnivele
Acele electroni care aparțin uneia și aceleiași subnivelul, adică electroni cu aceleași valori. Ei au aceeași energie. Această stare se numește energie degenerată.
Este nevoie de valori de la înainte. dar este, în general, valabil pentru atomi neexcitat pentru. De asemenea, valorile numerice si are denumiri scrisoare:
și anume numărul de subnivele de energie în cadrul unui nivel de energie dat;
- Forma orbitali atomici (a se vedea figura).
3. Numărul cuantic magnetic specifică:
- orbitali atomic orientare în spațiu;
- numărul de orbitali atomice din subnivel energetic.
este un număr întreg de la prin. și anume valori. De exemplu, ia în considerare un sub-strat, pentru el - doar o valoare. În consecință, numărul înseamnă că această subnivele energie sunt trei orbitali atomici, în mod diferit orientate în spațiu (Figura).
Cele de mai sus pot fi reprezentate sub forma unui tabel.
Tabelul 2.1 - Numărul orbitali în subnivele energetice
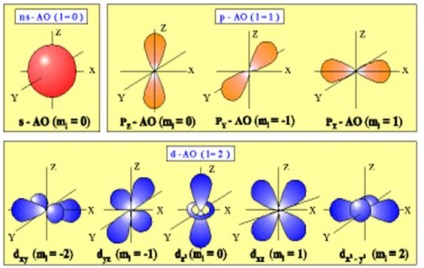
Figura 2.4. Configurarea orbitali atomici și orientarea lor în spațiu
orbitali sunt simetrice spherically pentru orice n și diferă numai în sfere de dimensiune.
orbitali există pentru. Prin urmare, există trei opțiuni de orientare în spațiu: Toate orbitali posedă plan nodal, împărțindu-orbital în două regiuni, astfel încât suprafața de delimitare au forma de gantere, orientate în spațiu, la un unghi unul față de altul. axele de simetrie ale acestora sunt axele de coordonate, care sunt desemnate.
orbitali sunt determinate de numărul cuantic. în care cele cinci variante de realizare se caracterizează prin orientarea în spațiu. orbitali, orientate de-a lungul axelor de coordonate, și sunt desemnate. și sa axat pe Bisectoarele coordonate unghiurile -
Șapte orbitali corespunzătoare. Mai au o configurație mai complexă și nu sunt prezentate în figură.
4. Numărul cuantic de spin (din limba engleză - rotație) poate fi reprezentat ca electroni simplificat descrie rotația în jurul propriei sale axe sensul acelor de ceasornic și invers acelor de ceasornic, așa că are doar două valori reprezentând cele două proeminențe ale momentului cinetic al unui electron în axa selectată.
Pentru imaginea și electronii orbitali atomici folosesc adesea „pătrate“ și „săgeți“, îndreptate în sus sau în jos. Doi electroni cu aceleași numere cuantice. dar cu spini opuse sunt numite gemene sau o pereche de electroni neîmpărtășită și sunt desemnate. electroni nepereche - sau.
Astfel, cele patru numere cuantice descriu starea unui electron dintr-un atom, și este caracterizat prin energia electronului, spin, forma norului de electroni și orientarea în spațiu. În tranziția de la un atom la altul starea de nor de electroni este rearanjat, adică modifica valorile numerelor cuantice, care este însoțită de absorbția sau emisia de atom cuante de energie.