complex de protrombină. Grupul glicopril-Thein plasmă. inclusiv factorii-II sale de coagulare (protrombină), VII, IX și X, precum și proteinele de reglementare SI și S, la- angajeze centru. link-ul consecutiv etapă. Activarea p-tiile proteinelor precursoare care conduc la formarea trombinei.

Proteinele complexului de protrombină (vezi. Tabelul.) Sunt caracterizate prin omologie cu structurile primare și terțiare, biosintezei și mecanisme comune de activare în formele active respective, Ila (trombina), VIIa. IXa. Ha si proteine Cia. proteine complexe protrombinice sunt sintetizate în ficat și suferă modificări postribosomal-ing în microzomi, înainte de secreție în sânge. Această modificare este controlată de vitamina K este de 10-12 carboxilarea glutamic la tine în regiunea N-terminală a fiecărei proteine pentru a forma resturi de g -karboksiglutaminovoy la-vă. Aceste solduri asigură capacitatea de a lega proteine de ioni complexe protrombinice de Ca + 2. prin la- se produce proteine de atașare la fosfolipide incarcate negativ pansament stimul membranelor celulare. Legarea este necesară concentrarea proteinelor complexe protrombinice atinge viteze mari de curgere consecutiv. r-tiile și reglementarea acestora în cascadă.
Deficit de vitamina K sau administrarea la antagoniști ai săi (de exemplu. Bishydroxycoumarin) conduce la o reducere sau inhibare completă a carboxilarea p-TION dependentă de vitamina a reziduurilor glutamic-te. Ca urmare, formarea defectuoasă a proteinelor complexe protrombină și a redus de coagulare a sângelui. Protrombinei proteinelor complexe, cu excepția protrombina. găsit puțin frecvente în organisme vii b -gidroksiasparaginovaya la-unu funktsion. valoarea unui roi este neclar. Cunoscut structura primară a proteinelor complexului protrombinei și genele izolate. care codifică biosintezei acestora.
Formele active ale proteinelor complexe protrombină reprezintă o serie de noi-proteolitich. enzime. Trebuie să-ryh katalitich. porțiune a sitului activ localizat în regiunea C-terminală a moleculei de lanț greu. După activare, proenzime (rezultând în eliminarea fragmentelor peptidice) C con tsevaya enzimă zonă rămâne legat de legăturile disulfidice domeniului N-terminal. prin care se realizează orientarea optimă a proteinelor pe membrana celulelor. Excepție-enzima trombină. să-ing, ca urmare a activării protrombinei pierde domeniu. conținând Ca 2+ site-uri care leagă ionii.
Katalitich. Enzimele Sfânt Insula sunt îmbunătățite prin leksoobrazovaniya lor Comp cu proteine regulatoare sau cofactori pentru membranele celulare pansament sti. Acestea includ: Factorul VIII-cofactor pentru factorul IXa. Factor V-cofactor Factor Xa. factor tisular (TF) - cofactorul factorului Vila. proteina S si trombomodulinului - proteina cofactor Sia. proteine Knob LARG asigura amplasarea optimă în apropierea corespunzătoare substraturi ale enzimelor. astfel proenzime rata de activare este crescut de zece mii de ori sau mai mult.
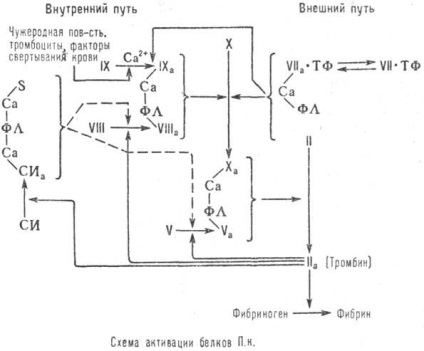
Mecanismul de conversie a proteinelor complexe protrombină (vezi. Figura) include exterior. cale, într-un țesut-factor lipopro-teină implicat-rom, format prin leziuni tisulare. și interne. Săgețile solide din diagramă arată calea de activare a proteinelor complexe protrombinice inhibare cale punctată a acestui proces (PL - fosfolipide ale membranei celulare). Trombina participă la etapa finală a cheagului de sânge prin activarea conversia fibrinogenului în fibrină.
Lit. Strayer L. Biochimie. per. din limba engleză. vol. 1, M. 1984, p. 152-76; Cu Jackson, Nemerson Y. "Ann. Rev. Biochem.", 1980, v. 49, p. 765-811.